解答题-原理综合题 适中0.65 引用1 组卷81
正丁醛可由丙烯通过下列反应制取:
CH3CH=CH2 + CO + H2 CH3CH2CH2CHO(正丁醛)反应①
CH3CH2CH2CHO(正丁醛)反应①
同时发生副反应:CH3CH=CH2 +CO + H2 (CH3)2CHCHO(异丁醛)反应②
(CH3)2CHCHO(异丁醛)反应②
CH3CH=CH2 + H2 CH3CH2CH3反应③
CH3CH2CH3反应③
三个反应在不同温度时的平衡常数见下表。回答问题:
(1)423K时,如果反应在恒容密闭容器中发生,当反应达到平衡时,下列说法错误的是_____ (填序号)。
a.c(CO):c( H2)一定等于1:1
b.反应混合物的密度保持不变
c.丙烯转化率达到最大值
d.单位时间内,n(CO)消耗= n(正丁醛)生成
(2)当反应达到平衡后,若将反应体系的温度从298 K提高到423 K,再次达到平衡后,在生成物中,__________ (填物质名称)的摩尔百分含量降低。
(3)若反应在298K进行,根据平衡常数作出的推测正确的是______ 。
a.反应③的反应速率最大 b.达到平衡后生成物中丙烷的体积百分含量最高
c.反应②达到平衡所需时间最长 d.298K时只有反应③向正反应方向进行
(4)使用催化剂后,单位时间里正丁醛的产量大大提高,反应体系产物中正/异醛比增大。导致这种情况出现的原因是____________________________ 。
CH3CH=CH2 + CO + H2
 CH3CH2CH2CHO(正丁醛)反应①
CH3CH2CH2CHO(正丁醛)反应①同时发生副反应:CH3CH=CH2 +CO + H2
 (CH3)2CHCHO(异丁醛)反应②
(CH3)2CHCHO(异丁醛)反应②CH3CH=CH2 + H2
 CH3CH2CH3反应③
CH3CH2CH3反应③三个反应在不同温度时的平衡常数见下表。回答问题:
| 温度/K | 反应① | 反应② | 反应③ |
| 298 | 2.96×109 | 2.53×109 | 1.32×1015 |
| 423 | 1.05×102 | 5.40×102 | 2.52×102 |
(1)423K时,如果反应在恒容密闭容器中发生,当反应达到平衡时,下列说法错误的是
a.c(CO):c( H2)一定等于1:1
b.反应混合物的密度保持不变
c.丙烯转化率达到最大值
d.单位时间内,n(CO)消耗= n(正丁醛)生成
(2)当反应达到平衡后,若将反应体系的温度从298 K提高到423 K,再次达到平衡后,在生成物中,
(3)若反应在298K进行,根据平衡常数作出的推测正确的是
a.反应③的反应速率最大 b.达到平衡后生成物中丙烷的体积百分含量最高
c.反应②达到平衡所需时间最长 d.298K时只有反应③向正反应方向进行
(4)使用催化剂后,单位时间里正丁醛的产量大大提高,反应体系产物中正/异醛比增大。导致这种情况出现的原因是
2012·上海徐汇·二模
类题推荐
丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。回答下列问题:
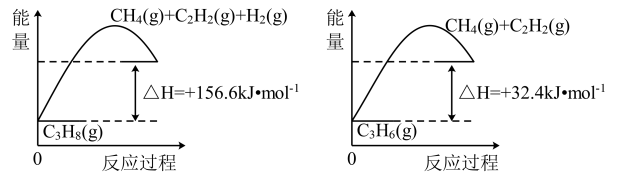
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=_______ kJ·mol-1。
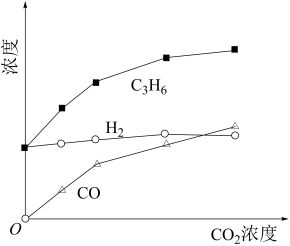
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为_______ (用化学方程式表示)。
(3)已知Arrhenius 经验公式为Rlnk=RlnA- (Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为
(Ea为活化能,k为速率常数,R、A为常数)。丙烷脱氢制备丙烯反应在某条件下的Arrhenius 经验公式的实验数据如图中曲线a所示,其活化能为_______ J·mol-1,当其实验数据发生变化如图中b线所示,则可能的原因是_______ 。

(4)工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
该温度下,若平衡时HCl的体积分数为10%。此时CH2=CHCH3的转化率为_______ 。反应①的压力平衡常数Kp=_______ kPa-1(保留小数点后2位)。
(5)一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。
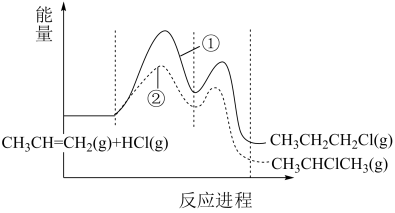
保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是_______。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)=C3H6(g)+H2(g) ΔH=

(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器发生脱氢反应。经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如下图所示。c(H2)和c(C3H6)变化差异的原因为

(3)已知Arrhenius 经验公式为Rlnk=RlnA-

(4)工业上用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3 (g)
②CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3和Cl2发生反应,容器内气体的压强随时间的变化如下表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 58 | 58 |
(5)一定条件下,CH3CH=CH2与HCl发生反应有①、②两种可能,反应进程中的能量变化如图所示。

保持其他条件不变,若要提高产物中CH3CH2CH2Cl(g)的比例,可采用的措施是_______。
| A.适当提高反应温度 | B.改变催化剂 |
| C.适当降低反应温度 | D.改变反应物浓度 |
汽车尾气中含有上百种化合物,污染物中以NO为主。请回答下列与NO相关的问题:
(1)汽车发动机工作时燃料燃烧会使氮气转化为NO。
已知:N2(g)+O2(g)=2NO(g) △H=+akJ·mol-1。NO中氮氧键键能为b kJ·mol-1、O=O键能为 c kJ·mol-1。
计算N_N的键能为____________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)NO和CO在一定温度和催化剂的条件下可发生反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-538 kJ·mol-1。
N2(g)+2CO2(g) △H=-538 kJ·mol-1。
一定温度下,向体积为2L的密闭容器中充入一定量的NO和CO,发生上述反应。反应过程中测定的部分数据见下表:
①反应在0~4 min内的平均速率v(CO)=_____________ 。
②下列叙述中,能说明反应已达到平衡的是____________ 。
a.NO的消耗速率和CO2的生成速率相等 b.容器内的压强不再变化
c.混合气体的密度不再变化 d.N2的百分含量不再变化
③计算该温度下的平衡常数K=____________ 。
④8min时,其他条件不变,向该反应容器中再通入0.05molNO和0.100CO,重新达到平衡时混合气体中N2的百分含量将____________ (填“减小”、“增大”或“不变” )。
(3)工业上采用电解NO的方法制备NH4NO3,其工作原理如图。X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充NH3。
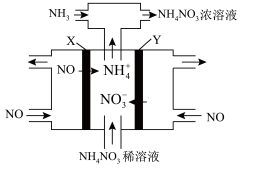
①Y电极上的电极反应式为_______________________________ 。
②若X电极上有11.2L(已换算成标准状况)NO发生反应,则生成NH4NO3的质量为____________ g。
(1)汽车发动机工作时燃料燃烧会使氮气转化为NO。
已知:N2(g)+O2(g)=2NO(g) △H=+akJ·mol-1。NO中氮氧键键能为b kJ·mol-1、O=O键能为 c kJ·mol-1。
计算N_N的键能为
(2)NO和CO在一定温度和催化剂的条件下可发生反应:
2NO(g)+2CO(g)
一定温度下,向体积为2L的密闭容器中充入一定量的NO和CO,发生上述反应。反应过程中测定的部分数据见下表:
时间/min | n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol |
0 | 0.100 | 0.200 | 0 | 0 |
4 | 0.020 | |||
6 | 0.050 | |||
8 | 0.025 |
②下列叙述中,能说明反应已达到平衡的是
a.NO的消耗速率和CO2的生成速率相等 b.容器内的压强不再变化
c.混合气体的密度不再变化 d.N2的百分含量不再变化
③计算该温度下的平衡常数K=
④8min时,其他条件不变,向该反应容器中再通入0.05molNO和0.100CO,重新达到平衡时混合气体中N2的百分含量将
(3)工业上采用电解NO的方法制备NH4NO3,其工作原理如图。X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充NH3。

①Y电极上的电极反应式为
②若X电极上有11.2L(已换算成标准状况)NO发生反应,则生成NH4NO3的质量为
汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
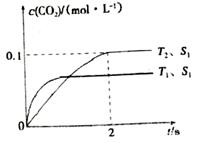
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2(g) CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
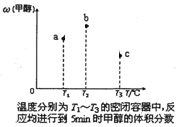
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
达到平衡时CO的转化率为__________。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol①反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2(g)
 CH3OH (g)
CH3OH (g)①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________

A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


