计算题 较难0.4 引用1 组卷246
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含量)。
(1)已知一个人一天大约要产生16molCO2,若全部被Na2O2吸收,需要Na2O2_________ g。
(2)若要使被吸收的CO2与产生的O2体积相等,就需要在Na2O2中添加KO2。计算要达到该目的,Na2O2与KO2的物质的量之比______ 已知: 4KO2 + 2CO2 → 2K2CO3 + 3O2
(3)计算100 L空气经过人体呼吸后,呼出气体中O2、H2O(g)、CO2的体积(相同状况下,保留2位小数)。__________________
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处理,无用物质排出航天器。100L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100L(可供使用的化学试剂只有Na2O2)。通过计算回答:若先利用CO2,是否还要利用水蒸气?若需要利用水蒸气,需要水蒸气多少升?_________
| 空气成分 | 人体呼出 气体成分 | |
| N2 | 78% | 73.65% |
| O2 | 21% | 15.92% |
| H2O | 0.5% | 5.97% |
| CO2 | 0.03% | 3.98% |
(1)已知一个人一天大约要产生16molCO2,若全部被Na2O2吸收,需要Na2O2
(2)若要使被吸收的CO2与产生的O2体积相等,就需要在Na2O2中添加KO2。计算要达到该目的,Na2O2与KO2的物质的量之比
(3)计算100 L空气经过人体呼吸后,呼出气体中O2、H2O(g)、CO2的体积(相同状况下,保留2位小数)。
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处理,无用物质排出航天器。100L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100L(可供使用的化学试剂只有Na2O2)。通过计算回答:若先利用CO2,是否还要利用水蒸气?若需要利用水蒸气,需要水蒸气多少升?
2013·上海徐汇·二模
类题推荐
为保持航天器中气体成分恒定,需处理人体呼出气体。下表列出相关气体的成分及含量:
(1)上述气体组分中,N2不参与人体新陈代谢,若有100L空气被人体吸入,则相同条件下,人体呼出气体的体积为___________ L。(保留1位小数)(均为体积百分含量)
(2)设航天器内有100L空气被人体吸入,现将呼出的气体通过Na2O2处理,若Na2O2先与呼出的CO2反应,再与呼出的H2O(g)作用;试通过计算回答:欲使气体恢复至原空气成分且体积仍为100L,是否还需额外补充水蒸气。若需要,应补充多少升的水蒸气;若不需要,应使多少升的水蒸气冷凝。(计算过程保留3位小数)___________ 。
| 成分 | 人体吸入空气 | 人体呼出气体 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O(g) | 0.5% | 6% |
| CO2 | 0.03% | 4% |
(2)设航天器内有100L空气被人体吸入,现将呼出的气体通过Na2O2处理,若Na2O2先与呼出的CO2反应,再与呼出的H2O(g)作用;试通过计算回答:欲使气体恢复至原空气成分且体积仍为100L,是否还需额外补充水蒸气。若需要,应补充多少升的水蒸气;若不需要,应使多少升的水蒸气冷凝。(计算过程保留3位小数)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
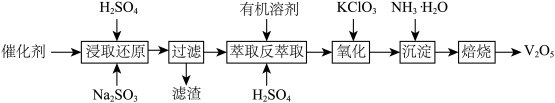
 2SO3。反应达到平衡后,将容器中的混合气体通过过量NaOH,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均已换算成标准状况下的体积)。(计算结果保留两位小数)将催化剂取出,此时催化剂中含有V2O5、VOSO4和SiO2等,其中VOSO4能溶于水,从中回收V2O5的主要流程如下:
2SO3。反应达到平衡后,将容器中的混合气体通过过量NaOH,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均已换算成标准状况下的体积)。(计算结果保留两位小数)将催化剂取出,此时催化剂中含有V2O5、VOSO4和SiO2等,其中VOSO4能溶于水,从中回收V2O5的主要流程如下: