解答题-原理综合题 较易0.85 引用2 组卷100
合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=_______ kJ·mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____ (保留两位小数)。
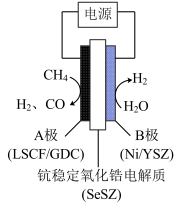
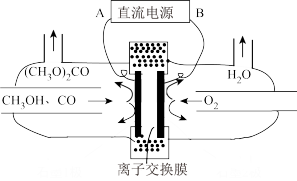
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____ (填“A”或“B’)极迁移;阳极发生的电极反应为___________ 。_____ (填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等于”或“小于”)b点,理由是_________ 。
③c点时,反应C(s) +CO2(g) 2CO(g)的Kp=
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______ ;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______ (填“增大”“减小”或“不变”)。
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向

②气体的总压强:a点
③c点时,反应C(s) +CO2(g)
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为
19-20高三下·福建三明·阶段练习
类题推荐
CO2和CH4是两种主要的温室气体,以CO2和CH4为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。回答下列问题:
(1)工业上CO2-CH4催化重整是目前大规模制取合成气(CO和H2混合气)的重要方法,其原理为:
反应I:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+206.4 kJ·mol-1
CO(g)+3H2(g) ∆H1=+206.4 kJ·mol-1
反应II:CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=-41 kJ·mol-1
CO2(g)+H2(g) ∆H2=-41 kJ·mol-1
几种化学键的键能如表所示:
①a=_______ kJ·mol-1。
②反应II中,若逆反应活化能Ea(逆)为124 kJ·mol-1,则Ea(正)为_______ kJ·mol-1。
(2)将等物质的量的CH4(g)和H2O(g)充入恒温恒容的密闭容器中,发生反应I和反应II,容器内气体的压强随时间的变化如表所示。
①若用单位时间内气体分压(气体分压=气体总压×体积分数)的变化来表示反应速率,则反应I前120min内的平均反应速率v(CH4)=_______ kPa·min-1(结果保留2位小数)。
②300 min时,测得氢气分压为100 kPa,则反应II在该温度下的平衡常数Kp=_______ (Kp为用气体分压表示的平衡常数,结果保留2位小数)。
(3)向2 L容器中充入1 mol CH4和1 mol H2O,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中CH4体积分数如图I所示,某温度下逆反应速率与容器中c(CH4)关系如图II所示:
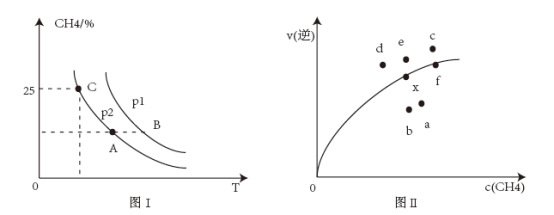
①图I中A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序为_______ ,p1_______ p2(填“>”“<”或“=”)。
②图II中当x点平衡体系升高至某温度时,反应可重新达平衡状态,新平衡点可能是_______ (填标号)。
(1)工业上CO2-CH4催化重整是目前大规模制取合成气(CO和H2混合气)的重要方法,其原理为:
反应I:CH4(g)+H2O(g)
反应II:CO(g)+H2O(g)
几种化学键的键能如表所示:
| 化学键 | C-H | H-O | H-H | C |
| 键能/kJ | 413 | 467 | 436 | a |
①a=
②反应II中,若逆反应活化能Ea(逆)为124 kJ·mol-1,则Ea(正)为
(2)将等物质的量的CH4(g)和H2O(g)充入恒温恒容的密闭容器中,发生反应I和反应II,容器内气体的压强随时间的变化如表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 100 | 118 | 132 | 144 | 154 | 162 | 162 |
①若用单位时间内气体分压(气体分压=气体总压×体积分数)的变化来表示反应速率,则反应I前120min内的平均反应速率v(CH4)=
②300 min时,测得氢气分压为100 kPa,则反应II在该温度下的平衡常数Kp=
(3)向2 L容器中充入1 mol CH4和1 mol H2O,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中CH4体积分数如图I所示,某温度下逆反应速率与容器中c(CH4)关系如图II所示:

①图I中A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序为
②图II中当x点平衡体系升高至某温度时,反应可重新达平衡状态,新平衡点可能是
甲醇(CH3OH)是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8 kJ·mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
回答下列问题:
(1)下列说法正确的是___________ (填标号)。
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是___________ (用化学方程式表示)。
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
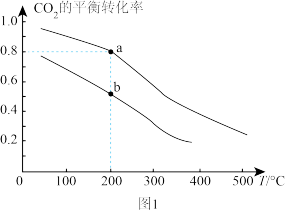
①a、b两点化学反应速率分别用va、vb,表示,则va___________ vb(填“大于”“小于”或“等于”)。
②a点对应的平衡常数K=___________ L2·mol-2(保留1位小数)。
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。
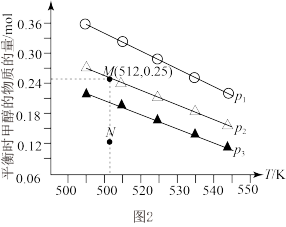
下列说法正确的是___________ (填标号)。
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为___________ (填“A”或“B”),阳极的电极反应式为___________ 。
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| 平衡时的浓度 | c1 | c2 | c3 |
| 平衡时反应的能量变化为正值 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡时反应物的转化率 | α1 | α2 | α3 |
(1)下列说法正确的是
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g)

①a、b两点化学反应速率分别用va、vb,表示,则va
②a点对应的平衡常数K=
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。

下列说法正确的是
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为

研究碳及其化合物的资源化利用具有重要的意义。回答下列问题:
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH3=
CO(g)+3H2(g)的ΔH3=___________ kJ/mol。
(2)能判断反应CO2(g)+4H2(g) CH4(g)+2H2O(g)达到平衡的是___________(填标号)。
CH4(g)+2H2O(g)达到平衡的是___________(填标号)。
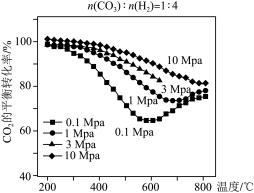
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是___________ 。 HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始
HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始 的关系如图所示:(分压=总压×物质的量分数)
的关系如图所示:(分压=总压×物质的量分数)___________ mol/(L·min)。
②b点时反应的平衡常数Kp=___________ (kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率___________ (填“增大”“不变”或“减小”)。
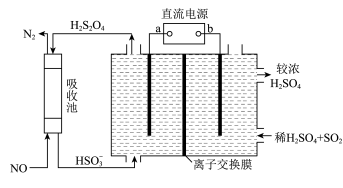
(5)氮的氧化物脱除可用电化学原理处理,如图装置可同时吸收 和NO。已知:
和NO。已知: 是一种弱酸。该装置中阴极的电极反应式为
是一种弱酸。该装置中阴极的电极反应式为___________ ,应选择___________ (填“阳”或“阴”)离子交换膜。
(1)已知下列热化学方程式:
反应I:CO2(g)+4H2(g)
反应II:CO2(g)+H2(g)
则反应CH4(g)+H2O(g)
(2)能判断反应CO2(g)+4H2(g)
| A.CO2的消耗速率和CH4的生成速率相等 |
| B.混合气体的密度不再发生变化 |
| C.容器内气体压强不再发生变化 |
| D.混合气体的平均相对分子质量不再发生变化 |
(3)将n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应I、II,在不同温度和压强时,CO2的平衡转化率如图。0.1MPa时,CO2的转化率在600°C之后,随温度升高而增大的主要原因是
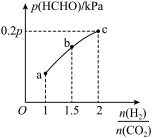
②b点时反应的平衡常数Kp=
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率
(5)氮的氧化物脱除可用电化学原理处理,如图装置可同时吸收
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


