解答题-原理综合题 较难0.4 引用2 组卷118
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
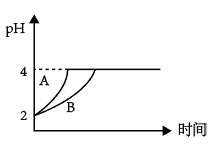
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
_____  平衡常数表达式为
平衡常数表达式为
_________________ 。
(2)相同温度下,若开始加入 的物质的量是原来的2倍,则
的物质的量是原来的2倍,则____ 是原来的2倍。
A.平衡常数 B. 的平衡浓度
的平衡浓度
C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的_____ 。
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将 的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
① 浓度为 的氨水b L;②
的氨水b L;②  的氨水c L;③
的氨水c L;③  的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:
的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________ 。
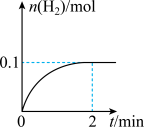
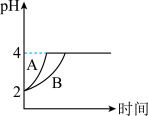
(5)常温下,取 的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是
的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___ (填“A”或“B”);设盐酸中加入的Zn质量为 ,醋酸溶液中加入的Zn质量为
,醋酸溶液中加入的Zn质量为 ,则
,则
___  。(选填“<”、“=”、“>”)
。(选填“<”、“=”、“>”)
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是____ 。
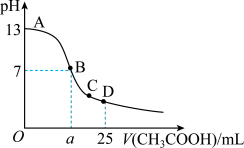
A.在A、B间任一点,溶液中一定都有
B.在B点, ,且有
,且有
C.在C点:
D.在D点:
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率
(2)相同温度下,若开始加入
A.平衡常数 B.
C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将
① 浓度为
(5)常温下,取

(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是

A.在A、B间任一点,溶液中一定都有
B.在B点,
C.在C点:
D.在D点:
14-15高三上·上海嘉定·期中
类题推荐
平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。回答下列各小题。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
(1)相同浓度的ClO-、 、
、 、
、 结合H+的能力最强的为
结合H+的能力最强的为_______ 。(填离子符号)
II.水在25℃和95℃时电离平衡曲线如图。
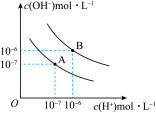
(2)已知在25℃时,将pH=12的NaOH溶液与pH=2的H2SO4溶液均升温至35℃,两溶液pH变化分别为_______(填字母)。
(3)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为_______ 。
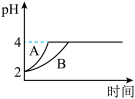
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量Zn粒,反应过程中两溶液pH变化如图。图中表示醋酸溶液中pH变化曲线_______ (填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1_______ m2。 (选填“<”、“=”、“>”)
(5)25 C时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图所示。
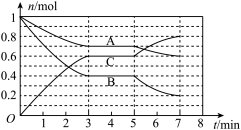
根据图1数据。写出该反应的化学方程式:_______ ;在5~7min内,若K值不变,则此处曲线变化的原因是_______ 。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
(1)相同浓度的ClO-、
II.水在25℃和95℃时电离平衡曲线如图。

(2)已知在25℃时,将pH=12的NaOH溶液与pH=2的H2SO4溶液均升温至35℃,两溶液pH变化分别为_______(填字母)。
| A.增加、减小 | B.增加、增加 | C.减小、不变 | D.不变、减小 |
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量Zn粒,反应过程中两溶液pH变化如图。图中表示醋酸溶液中pH变化曲线

(5)25 C时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图所示。

根据图1数据。写出该反应的化学方程式:
化学学科中的平衡理论主要包括化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g)⇌4C(g) ΔH>0达到平衡时,若改变条件重新达到平衡后体系中A的转化率增大,则可行的措施是_______。
(2)某溶液是由体积相等的NaOH溶液和醋酸溶液混合而成的,且恰好呈中性,则混合前c(NaOH)_______ (填“>”“=”或“<”,下同)c(CH3COOH),混合后溶液中c(CH3COO-)_______ c(Na+)。
(3)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒(不考虑Zn对反应速率的影响),反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液的pH变化的曲线是_______ (填“A”或“B”)。设盐酸中加入Zn的质量为m1,醋酸中加入Zn的质量为 m2,则m1_______ m2。

(1)在固定容积的密闭容器中,反应A(g)+2B(g)⇌4C(g) ΔH>0达到平衡时,若改变条件重新达到平衡后体系中A的转化率增大,则可行的措施是_______。
| A.增加B的物质的量 | B.加压 |
| C.升温 | D.使用催化剂 |
(3)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒(不考虑Zn对反应速率的影响),反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液的pH变化的曲线是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网