解答题-原理综合题 适中0.65 引用1 组卷117
I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是________ ;其与水反应的化学方程式为____________ 。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为________ 。氧原子的核外电子排布式为__________ 。
(3)与同主族元素Mg相比,Ca的金属性更______ (填“强”或者“弱”)。能证明这一结论的实验事实是__________ 。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)⇌CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是________ 。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为_______ 。
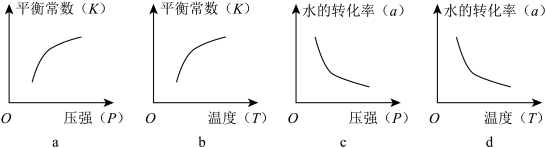
②下列图像正确的是________ 。(选填编号)
(1)电石的主要成分是CaC2,CaC2的晶体类型是
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为
(3)与同主族元素Mg相比,Ca的金属性更
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)⇌CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为
②下列图像正确的是

2015·上海浦东新·一模
类题推荐
用焦炭生产水煤气的反应为:C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
(1)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是___________。(选填编号)
(2)将不同量的 C (s)和 H2O (g)分别加入到体积为 2 L 的恒容密闭容器中,进行反应,得到如下数据:
实验 1 中以 v(H2) 表示的到达平衡时的平均反应速率为___________ 。
(1)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是___________。(选填编号)
| A.容器中的压强不再改变 |
| B.混合气体的密度不再改变 |
| C.v 正(CO)=v 逆(H2O) |
| D.c(CO)=c(H2) |
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是_________ (填字母序号)。
a.ν(CO)消耗= ν(H2O)生成b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为____________ 。
②A =___________________ 。
③平衡常数:K(900℃)________ K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是______________________________________________________________________ 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是_______ 。这四种元素形成的化合物______________ (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是______________ (选填编号)。
a.酸性:H2CO3强于H2SiO3b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
 CO2(g) + H2(g)
CO2(g) + H2(g)完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是
a.ν(CO)消耗= ν(H2O)生成b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为
②A =
③平衡常数:K(900℃)
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是
27.能证明碳的非金属性比硅强的事实是
a.酸性:H2CO3强于H2SiO3b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


