解答题-原理综合题 适中0.65 引用1 组卷196
研究氮及其化合物对化工生产有重要意义。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g) N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=__ (用△H1、△H2、△H3表示)。
(2)在2L密闭绝热容器中,投入4mol N2和6mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
①下列能说明该反应已达到平衡状态的是__ 。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1__ (填“>”<”或“=”)T3。
③在T3温度下,达到平衡时N2的转化率为__ 。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g) 2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为
2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为__ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=__ kPa·s-1。
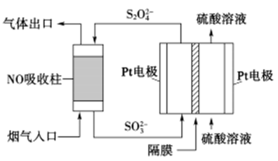
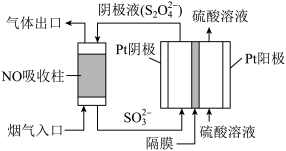
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为__ ,电解槽中的隔膜为__ (填“阳”或“阴”)离子交换膜。每处理1mol NO,电路中通过电子的物质的量为__ 。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g)
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=
(2)在2L密闭绝热容器中,投入4mol N2和6mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
温度/K | T1 | T2 | T3 | T4 |
n(NH3)/mol | 3.6 | 3.2 | 2.8 | 2.0 |
①下列能说明该反应已达到平衡状态的是
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1
③在T3温度下,达到平衡时N2的转化率为
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)
 2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为
2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为

19-20高三下·河北衡水·阶段练习
类题推荐
合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如表:
①下列能说明该反应已达到平衡状态的是___ 。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1___ (填“>”“<”或“=”)T3。
③在T3温度下,达到平衡时N2的体积分数____ 。
(2)N2O4为重要的火箭推进剂之一、N2O4与NO2转换的热化学方程式为N2O4(g) 2NO2(g)△H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为
2NO2(g)△H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为___ (以k正、k逆表示)。若将定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=____ kPa·s-1。
(3)T℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g) 2NH3(g),反应过程中各物质浓度的变化曲线如图所示:
2NH3(g),反应过程中各物质浓度的变化曲线如图所示:
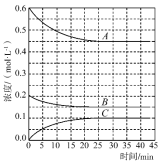
①表示H2浓度变化的曲线是____ (填“A”、“B”或“C”。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是___ 。
②在0~25min内N2的平均反应速率为___ 。在该条件下反应的平衡常数为___ mol-2·L2(保留两位有效数字)。
(1)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如表:
| 温度/K | T1 | T2 | T3 | T4 |
| n(NH3)/mol | 3.6 | 3.2 | 2.8 | 2.0 |
①下列能说明该反应已达到平衡状态的是
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1
③在T3温度下,达到平衡时N2的体积分数
(2)N2O4为重要的火箭推进剂之一、N2O4与NO2转换的热化学方程式为N2O4(g)
(3)T℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g)

①表示H2浓度变化的曲线是
②在0~25min内N2的平均反应速率为
合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家 F。 Haber从1902年开始研究N2和H2直接合成NH3.在1.01×105 Pa、250℃时,将1 mol N2和1 mol H2加入a L刚性容器中充分反应,测得NH3体积分数为4%,其他条件不变,温度升高至450℃,测得NH3体积分数为2.5%,则可判断合成氨反应△H___________ 0(填“>”或“<”)。
(2)在2 L密闭绝热容器中,投入4 mol N2和6 mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
①下列能说明该反应已达到平衡状态的是___________ 。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1___________ (填“>”“<”或“=”)T3。
③在T3温度下,达到平衡时N2的体积分数___________ 。
(3)N2O4为重要的火箭推进剂之一、N2O4与NO2转换的热化学方程式为N2O4(g) 2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为
2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为___________ (以k正、k逆表示)。若将定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110 kPa),已知该条件下k逆=5×102 kPa-1·s-1,当N2O4分解10%时,v逆=___________ kPa·s-1。
(4)T℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g) 2NH3(g),反应过程中各物质浓度的变化曲线如图所示:
2NH3(g),反应过程中各物质浓度的变化曲线如图所示:
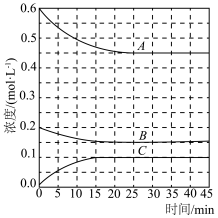
①表示H2浓度变化的曲线是___________ (填“A”、“B”或“C”。与(1)中的实验条件(1.01×105 Pa、450℃)相比,改变的条件可能是___________ 。
②在0~25 min内N2的平均反应速率为___________ 。在该条件下反应的平衡常数为______ mol-2·L2(保留两位有效数字)。
(1)德国化学家 F。 Haber从1902年开始研究N2和H2直接合成NH3.在1.01×105 Pa、250℃时,将1 mol N2和1 mol H2加入a L刚性容器中充分反应,测得NH3体积分数为4%,其他条件不变,温度升高至450℃,测得NH3体积分数为2.5%,则可判断合成氨反应△H
(2)在2 L密闭绝热容器中,投入4 mol N2和6 mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
| 温度/K | T1 | T2 | T3 | T4 |
| n(NH3)/mol | 3.6 | 3.2 | 2.8 | 2.0 |
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1
③在T3温度下,达到平衡时N2的体积分数
(3)N2O4为重要的火箭推进剂之一、N2O4与NO2转换的热化学方程式为N2O4(g)
(4)T℃时,在恒温恒容的密闭条件下发生反应:N2(g)+3H2(g)

①表示H2浓度变化的曲线是
②在0~25 min内N2的平均反应速率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网