单选题 容易0.94 引用1 组卷177
H2或CO可以催化还原NO以达到消除污染的目的。已知一定温度下
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
下列有关说法错误的是( )
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
下列有关说法错误的是( )
| A.H2催化还原NO生成氮气和液态水的热化学方程式为:2H2(g)+2NO(g)=N2(g)+2H2O(l) ΔH=-752.1kJ·mol-1 |
| B.汽车排气筒内安装尾气催化转化器可大大降低氮氧化物的排放 |
| C.硝酸厂产生的尾气只要通入一定量氢气即可达到排放标准 |
| D.CO催化还原NO生成无污染的气体33.6L(标准状况),放出热量为373.25kJ |
19-20高二上·山东青岛·期末
类题推荐
已知一定温度下的一些热化学方程式:
N2(g)+O2(g)=2NO(g) △H=+ 180.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) △H= -571.6 kJ·mol-1
则该温度下H2催化还原22.4L(标准状况下)NO达到消除环境污染目的的能量变化为
N2(g)+O2(g)=2NO(g) △H=+ 180.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(l) △H= -571.6 kJ·mol-1
则该温度下H2催化还原22.4L(标准状况下)NO达到消除环境污染目的的能量变化为
| A.放出376. 05 kJ | B.放出752.1 kJ |
| C.吸收376.05 kJ | D.吸收752.1kJ |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是 N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6mol•L-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6mol•L-1。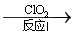 NO2
NO2 N2。
N2。

