解答题-原理综合题 适中0.65 引用4 组卷255
(1)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=131.3kJ·mol−1
C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2=90kJ·mol−1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是_______
(2)由合成气制甲醇
合成气CO和H2在一定条件下能发生反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。
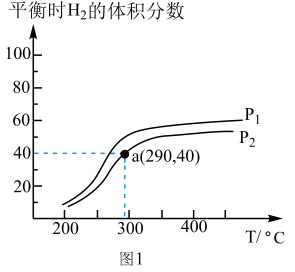
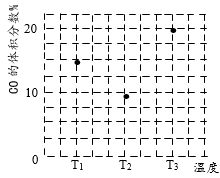
①在容积均为VL的甲、乙、丙、丁四个密闭容器中分别充入amolCO和2amolH2,四个容器的反应温度分别为T1、T2、T3、T4且恒定不变。在其他条件相同的情况下,实验测得反应进行到tmin时H2的体积分数如图所示,则T3温度下的化学平衡常数为_______ (用a、V表示)
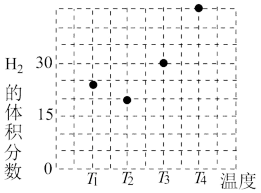
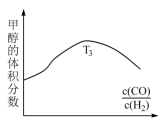
②图反映的是在T3温度下,反应进行tmin后甲醇的体积分数与反应物初始投料比 的关系,请画出T4温度下的变化趋势曲线。
的关系,请画出T4温度下的变化趋势曲线。_______
③在实际工业生产中,为测定恒温恒压条件下反应是否达到平衡状态,可作为判断依据的是_______
A.容器内气体密度保持不变 B.CO 的体积分数保持不变
C.气体的平均相对分子质量保持不变 D.c(H2)=2c(CH3OH)
(3)由甲醇制烯烃
主反应:2CH3OH⇌C2H4+2H2O i;
3CH3OH⇌C3H6+3H2O ii
副反应:2CH3OH⇌CH3OCH3+H2O iii
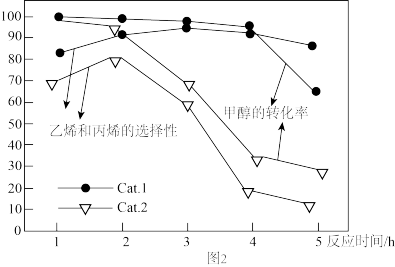
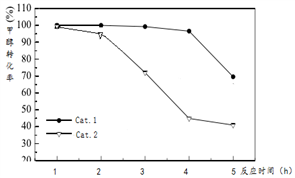
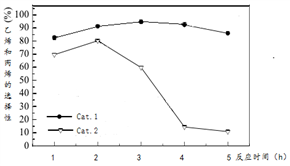
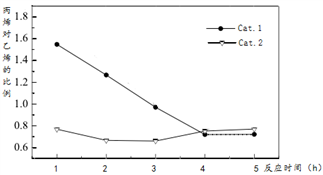
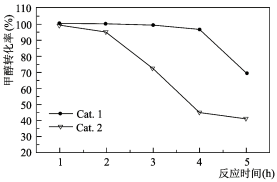
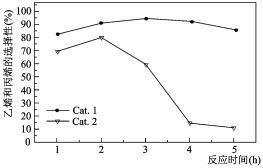
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到如下实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
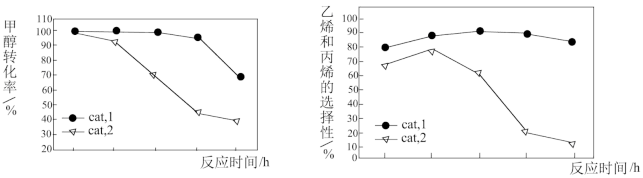
由图象可知,使用Cat。2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是(结合碰撞理论解释)_______
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=131.3kJ·mol−1
C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2=90kJ·mol−1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(2)由合成气制甲醇
合成气CO和H2在一定条件下能发生反应:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。
①在容积均为VL的甲、乙、丙、丁四个密闭容器中分别充入amolCO和2amolH2,四个容器的反应温度分别为T1、T2、T3、T4且恒定不变。在其他条件相同的情况下,实验测得反应进行到tmin时H2的体积分数如图所示,则T3温度下的化学平衡常数为

②图反映的是在T3温度下,反应进行tmin后甲醇的体积分数与反应物初始投料比

③在实际工业生产中,为测定恒温恒压条件下反应是否达到平衡状态,可作为判断依据的是
A.容器内气体密度保持不变 B.CO 的体积分数保持不变
C.气体的平均相对分子质量保持不变 D.c(H2)=2c(CH3OH)
(3)由甲醇制烯烃
主反应:2CH3OH⇌C2H4+2H2O i;
3CH3OH⇌C3H6+3H2O ii
副反应:2CH3OH⇌CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat。1和Cat。2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到如下实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比)

由图象可知,使用Cat。2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是(结合碰撞理论解释)
19-20高三下·浙江杭州·阶段练习
类题推荐
I.NO2是大气污染的主要污染物之一;硝酸盐是水体污染的污染物之一、
(1)用Na2CO3溶液吸收NO2生成CO2。若9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是___________ 。
II.为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(2)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)=CO(g)+H2(g) ∆H1=+131.3kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是___________ 。
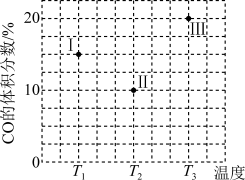
(3)由合成气制甲醇合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。在容积均为VL的甲、乙、丙三个密闭容器中分别充入amolCO和2amolH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是___________ (填“T1”或“T2”或“T3”);该温度下的化学平衡常数为___________ (用a、V表示)。
(4)由甲醇制烯烃
主反应:2CH3OH⇌C2H4+2H2O i
3CH3OH⇌C3H6+3H2O ii
副反应:2CH3OH⇌CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如下实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)

下列说法错误的是___________。
(1)用Na2CO3溶液吸收NO2生成CO2。若9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是
II.为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(2)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)=CO(g)+H2(g) ∆H1=+131.3kJ•mol-1
C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)由合成气制甲醇合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)⇌CH3OH(g)。在容积均为VL的甲、乙、丙三个密闭容器中分别充入amolCO和2amolH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是

(4)由甲醇制烯烃
主反应:2CH3OH⇌C2H4+2H2O i
3CH3OH⇌C3H6+3H2O ii
副反应:2CH3OH⇌CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如下实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)



下列说法错误的是___________。
| A.反应进行一段时间后甲醇的转化率下降,可能的原因是催化剂失活,工业生产中需定期更换催化剂 |
| B.使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚 |
| C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯 |
| D.不管使用Cat.1还是使用Cat.2,都能提高活化分子的百分数 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网