解答题-原理综合题 适中0.65 引用2 组卷233
SO2是空气中主要的大气污染物,国家规定在排放前必须经过处理。
Ⅰ.碱液吸收法:工业上常用NaOH溶液做吸收液。
(1)向0.5L1 mol·L-1的NaOH溶液中通入标准状态下11.2L的SO2。
①写出反应的离子方程式__________ ;
②已知:Ka1=1.54×10-2,Ka2=1.02×10-7,则所得溶液呈_______ (填“酸性”、“碱性”或“中性”),下列有关吸收液中粒子浓度大小关系正确的是_________ 。
A c(H2SO3)>c(SO32-)
B c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
C c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)
D c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
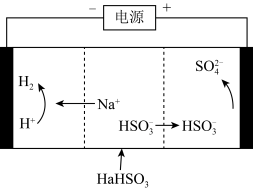
(2)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收SO2后所得溶液以实现吸收液的回收再利用,装置如下图所示:
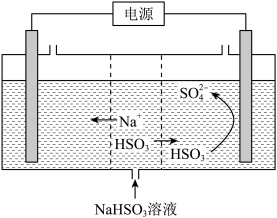
①工作一段时间后,阴极区溶液的pH_______ (填“增大”、“减小”或“不变”)。
②写出阳极的电极反应式_______ 。
Ⅱ.SO2的回收利用:
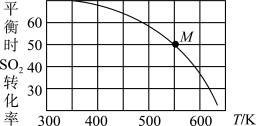
(3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g) SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:

① 该反应的ΔH________ (填“>”、“<”或“=”)0。
② 若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=_____ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
Ⅰ.碱液吸收法:工业上常用NaOH溶液做吸收液。
(1)向0.5L1 mol·L-1的NaOH溶液中通入标准状态下11.2L的SO2。
①写出反应的离子方程式
②已知:Ka1=1.54×10-2,Ka2=1.02×10-7,则所得溶液呈
A c(H2SO3)>c(SO32-)
B c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-)
C c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)
D c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
(2)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收SO2后所得溶液以实现吸收液的回收再利用,装置如下图所示:

①工作一段时间后,阴极区溶液的pH
②写出阳极的电极反应式
Ⅱ.SO2的回收利用:
(3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)

① 该反应的ΔH
② 若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=
2020·湖南永州·二模
类题推荐
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1< 0 其平衡常数为K1
2ClNO(g) △H1< 0 其平衡常数为K1
ii.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=____ (用K1、K2表示),反应热△H3=____ (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) =__________________ ,平衡常数K2=________________ ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) =_________ α2(NO2)(填“>”“<”或“=”)。
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是_____________ 。
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
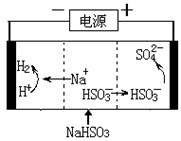
①工作一段时间后,阴极区溶液的pH_____ (填“增大”“减小”或“不变”);
②写出阳极的电极反应式______________________ 。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g)
ii.2NO2(g)+NaCl(s)
(1)现有反应4NO2(g)+2NaCl(s)
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) =
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) =
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则

①工作一段时间后,阴极区溶液的pH
②写出阳极的电极反应式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
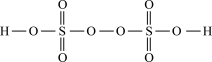 。在工业上用作强氧化剂。
。在工业上用作强氧化剂。