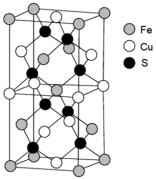
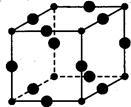
解答题-原理综合题 适中0.65 引用3 组卷298
氮、铜及其化合物以及乙醇、氯化钠的用途广泛。回答下列问题:
(1)基态氮原子中含有______ 种运动状态不同的电子,与N3-含有相同电子数的四原子分子是_______ (写化学式),其立体构型是________ 。
(2)C、N、O、F四种元素的第一电离能由小到大的顺序为_____ 。
(3)Cu+价层电子的轨道表达式(电子排布图)为______ 。CuO在高温下能分解生成Cu2O,其原因是_______ 。
(4)在加热和Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是____ ,乙醛分子中H一C—O的键角____ (填“大于”等于”或“小于”)乙醇分子中的H—C—O的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代后有两种不同的结构,其中[Cu( H2O)2(Cl)2]是非极性分子的结构式为________ 。
(6)如图所示为NaCl晶体的晶胞结构图和晶胞截面图(截面图中的大球为Cl-,小球为Na+);

①晶胞中距离1个Na+最近的Cl-有_____ 个 ,这些C1-围成的图形是___________ 。
②若晶体密度为ρg●cm-3,阿伏加 德罗常数的值用NA表示,则Na+的离子半径为_______ pm(列出计算表达式)。
(1)基态氮原子中含有
(2)C、N、O、F四种元素的第一电离能由小到大的顺序为
(3)Cu+价层电子的轨道表达式(电子排布图)为
(4)在加热和Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代后有两种不同的结构,其中[Cu( H2O)2(Cl)2]是非极性分子的结构式为
(6)如图所示为NaCl晶体的晶胞结构图和晶胞截面图(截面图中的大球为Cl-,小球为Na+);

①晶胞中距离1个Na+最近的Cl-有
②若晶体密度为ρg●cm-3,阿伏加 德罗常数的值用NA表示,则Na+的离子半径为
2020·黑龙江齐齐哈尔·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网