解答题-实验探究题 适中0.65 引用2 组卷178
某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________ mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______ 。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________ 。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________ 。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________ 。
(5)钠离子交换树脂的原理为Mn++nNaR MRn+nNa+,被交换的杂质离子是
MRn+nNa+,被交换的杂质离子是________ 。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7 | — | — | — |
| 沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是
(4)调节溶液的pH=8除去的杂质离子是
(5)钠离子交换树脂的原理为Mn++nNaR
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。
20-21高三上·四川成都·周测
类题推荐
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
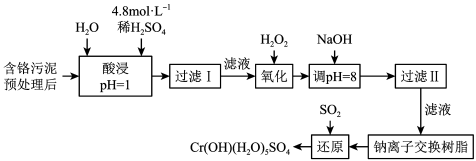
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol⋅L-1的浓硫酸配制250mL4.8mol⋅L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___ 。
(2)酸浸时,为了提高浸取率可采取的措施是___ (至少两条)。
(3)加入H2O2的作用是___ 。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是___ 。
(5)还原过程发生以下反应(请配平):__ Na2Cr2O7+__ SO2+__ =__ Cr(OH)(H2O)5SO4+__ Na2SO4;
(6)从流程的滤液中可回收的主要物质是___ 。

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解 |
(1)实验室用18.4mol⋅L-1的浓硫酸配制250mL4.8mol⋅L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需
(2)酸浸时,为了提高浸取率可采取的措施是
(3)加入H2O2的作用是
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(5)还原过程发生以下反应(请配平):
(6)从流程的滤液中可回收的主要物质是
某工厂“对制革工业污泥中Cr(III)回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
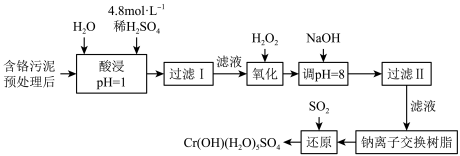
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol∙L-1的浓硫酸配制250mL4.8mol∙L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___________ 。
(2)酸浸时,为了提高浸取率可采取的措施是___________ (至少两条)。
(3)加入H2O2的作用是___________ ,反应的离子方程式为___________
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___________ 。
(5)还原过程发生以下反应(请完成):___________ 。
_______Na2Cr2O7+SO2+( )=_______Cr(OH)(H2O)5SO4+_______Na2SO4
(6)从流程的滤液中可回收的主要物质是___________

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ | Ca2+ |
| 开始沉淀时pH | 1.9 | 7.0 | ___ | __ | 4.7 | __ | ___ |
| 完全沉淀时pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) | 12.3 |
(1)实验室用18.4mol∙L-1的浓硫酸配制250mL4.8mol∙L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需
(2)酸浸时,为了提高浸取率可采取的措施是
(3)加入H2O2的作用是
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(5)还原过程发生以下反应(请完成):
_______Na2Cr2O7+SO2+( )=_______Cr(OH)(H2O)5SO4+_______Na2SO4
(6)从流程的滤液中可回收的主要物质是
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
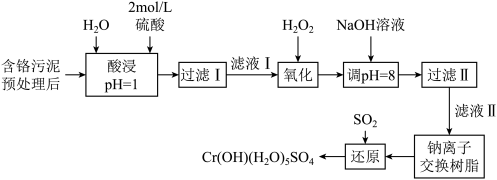
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______________ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________________________ 。
(2)H2O2的作用是_____________________________________ (用离子方程式表示)。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为_______ (填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + nNaR = MRn + nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________ 。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:____________________ 。

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(2)H2O2的作用是
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为
(4)钠离子交换树脂的反应原理为:Mn+ + nNaR = MRn + nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


