解答题-原理综合题 适中0.65 引用1 组卷516
CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
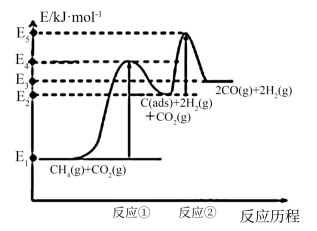
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g) C(ads)+2H2(g) (慢反应)
C(ads)+2H2(g) (慢反应)
反应②:C(ads)+ CO2(g) 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
(1)CH4与CO2制备“合成气”的热化学方程式为_________ 。能量变化图中:E5+E1_________ E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+ (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:v正____ v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________ (填标号)。
A < B
B  C >
C > D 无法确定
D 无法确定
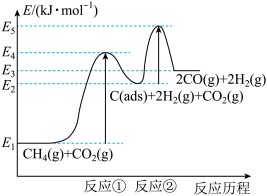
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)
反应②:C(ads)+ CO2(g)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

(1)CH4与CO2制备“合成气”的热化学方程式为
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)
(2)反应达到平衡后,仅升高温度,k正增大的倍数
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A <
2020·广东深圳·一模
类题推荐  的回收与利用是科学家研究的热点课题。可利用
的回收与利用是科学家研究的热点课题。可利用 与
与 制备合成气(CO、
制备合成气(CO、 ),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
Ⅰ.科学家提出制备“合成气”反应历程分两步:
反应①: (慢反应)
(慢反应)
反应②: (快反应)
(快反应)
上述反应中 为吸附性活性炭,反应历程的能量变化如图:
为吸附性活性炭,反应历程的能量变化如图:
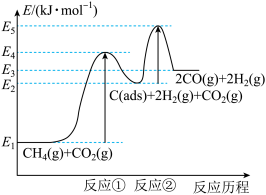
(1) 与
与 制备合成气的热化学方程式为
制备合成气的热化学方程式为_______ ;该反应在高温下可自发正向进行的原因是_______ ,能量变化图中:
_______  (填“>”“<”或“=”),
(填“>”“<”或“=”),
Ⅱ.利用“合成气”合成甲醇后,脱水制得二甲醚。
反应为:

经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在关系: (自然对数)
(自然对数) 。其速率方程为:
。其速率方程为: ,
,
 ,、为速率常数,且影响外因只有温度。
,、为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______  增大的倍数(填“>”“<”或“=”)。
增大的倍数(填“>”“<”或“=”)。
(3)某温度下, ,在密闭容器中加入一定量
,在密闭容器中加入一定量 。反应到某时刻测得各组分的物质的量如下:
。反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
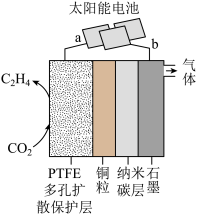
Ⅲ.合成低碳烯烃
(4)强碱性电催化还原 制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的
制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的_______ 极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式_______ 。
Ⅰ.科学家提出制备“合成气”反应历程分两步:
反应①:
反应②:
上述反应中

(1)
Ⅱ.利用“合成气”合成甲醇后,脱水制得二甲醚。
反应为:
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在关系:
(2)反应达到平衡后,仅升高温度,
(3)某温度下,
| 物质 | |||
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:
Ⅲ.合成低碳烯烃
(4)强碱性电催化还原

科研工作者积极展开了碳的氧化物和烃的含氧衍生物在新能源和精细化工方面应用的研究。
Ⅰ.CO和CH4,在一定条件下可发生反应:CO(g)+CH4(g) CH3CHO(g)。
CH3CHO(g)。
(1)向2L恒容密闭容器中充入2 mol CO和a mol CH4,在一定条件下发生反应,CO的平衡转化率与温度、投料比[X= ]的关系如下图所示。
]的关系如下图所示。
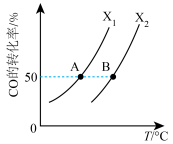
①X1____ X2(填“>”“<”或“ =”,下同),平衡常数KA____ KB,理由是__________ 。
②若A点混合气体中CH3CHO(g)的体积分数为25%,则X1 =_______ 。
(2)在T K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生上述反应,反应速率v = v 正-v逆 = k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p = 气体总压p总×体积分数)。
①反应达到平衡后,仅升高温度,k正增大的倍数____ k逆增大的倍数(填“>”、“<”或“=”)。
②若用气体分压表示的平衡常数Kp= 4.5×10-5(kPa)-1,当CO的转化率为20%时, =
=____ 。
Ⅱ.CO2的回收与利用是科学家研究的热点课题,可利用CO2与CH4制备甲醇、二甲醚等燃料产品。合成甲醇后,可脱水制得二甲醚,反应为:2CH3OH(g) CH3OCH3(g) + H2O(g)。经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度(单位为K)存在如下关系:lnK = −2.205 +
CH3OCH3(g) + H2O(g)。经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度(单位为K)存在如下关系:lnK = −2.205 +  。
。
(1)在一定温度范围内,随温度升高,CH3OH(g)平衡转化率将_____ (填“增大”、 “减小”或“不变”)。
(2)某温度下,K=200,在密闭容器中加入一定量CH3OH,反应到某时刻测得各组分的物质的量如下:
此时该可逆反应_______ (填“正向进行”、 “逆向进行”或“已达平衡”)。
(3)在恒容真空密闭容器中加入一定量的CH3OH(g),在T ℃下测得CH3OH(g)的体积分数随时间变化如图所示。若保持温度不变,在t3时刻向容器内再加入一定量的CH3OH(g),t4时刻重新达到平衡,请在图中画出t3~t5这段时间内CH3OH(g)体积分数的变化曲线_____ 。

(4)500 K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数_____ 。
A 小于 B 等于
B 等于 C 大于
C 大于  D 不能确定
D 不能确定
Ⅰ.CO和CH4,在一定条件下可发生反应:CO(g)+CH4(g)
(1)向2L恒容密闭容器中充入2 mol CO和a mol CH4,在一定条件下发生反应,CO的平衡转化率与温度、投料比[X=

①X1
②若A点混合气体中CH3CHO(g)的体积分数为25%,则X1 =
(2)在T K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生上述反应,反应速率v = v 正-v逆 = k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p = 气体总压p总×体积分数)。
①反应达到平衡后,仅升高温度,k正增大的倍数
②若用气体分压表示的平衡常数Kp= 4.5×10-5(kPa)-1,当CO的转化率为20%时,
Ⅱ.CO2的回收与利用是科学家研究的热点课题,可利用CO2与CH4制备甲醇、二甲醚等燃料产品。合成甲醇后,可脱水制得二甲醚,反应为:2CH3OH(g)
(1)在一定温度范围内,随温度升高,CH3OH(g)平衡转化率将
(2)某温度下,K=200,在密闭容器中加入一定量CH3OH,反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.5 | 0.5 | 0.5 |
此时该可逆反应
(3)在恒容真空密闭容器中加入一定量的CH3OH(g),在T ℃下测得CH3OH(g)的体积分数随时间变化如图所示。若保持温度不变,在t3时刻向容器内再加入一定量的CH3OH(g),t4时刻重新达到平衡,请在图中画出t3~t5这段时间内CH3OH(g)体积分数的变化曲线

(4)500 K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数
A 小于
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网