解答题-原理综合题 较难0.4 引用1 组卷114
在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术 获国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。
获国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的气化:用化学方程式表示出煤的气化的主要反应______ :
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
①
______  填“
填“ ”、“
”、“ ”、“
”、“ ”
” ,c与a、b之间的定量关系为
,c与a、b之间的定量关系为 ______ 。
②
______ ,若反应 是在容积为2L的密闭容器中进行
是在容积为2L的密闭容器中进行 的,测得某一时刻体系内
的,测得某一时刻体系内 、
、 、
、 、
、 物质的量分别为6mol、2mol、10mol、10mol,则此时
物质的量分别为6mol、2mol、10mol、10mol,则此时 的生成速率
的生成速率 ______  填“
填“ ”、“
”、“ ”、“
”、“ ”
”
 的消耗速率。
的消耗速率。
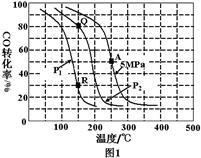
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系 选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯
选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯 。
。
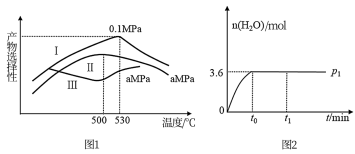
①为尽可能多地获得乙烯,控制的生产条件为______ 。
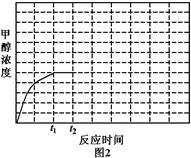
②一定温度下某密闭容器中存在反应, 在压强为
在压强为 时,产物水的物质的量与时间的关系如图2所示,若
时,产物水的物质的量与时间的关系如图2所示,若 时刻,测得甲醇的体积分数为
时刻,测得甲醇的体积分数为 ,此时甲醇乙烯化的转化率为
,此时甲醇乙烯化的转化率为 ______  保留三位有效数字
保留三位有效数字 ,若在
,若在 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间间关系图
时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间间关系图______________
(1)煤的气化:用化学方程式表示出煤的气化的主要反应
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| ① | | |
| ② | | |
| ③ | | |
①
②
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系

①为尽可能多地获得乙烯,控制的生产条件为
②一定温度下某密闭容器中存在反应,
19-20高三上·云南楚雄·期末
类题推荐
I.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。其反应如下:
反应1(主):
反应2(副):
温度高于300C则会同时发生反应3: ,回答下列问题:
,回答下列问题:
(1)反应1能够自发进行的原因是_______ 。
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是_______ 。
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应_______ 。
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
①反应I的平衡常数表达式K1=_______ ;
②b_______ 0(填“>”“<”或“=”),c与a、b之间的定量关系为_______ 。
③K3=_______ ,若反应Ⅲ是在500℃、容积为2L的密闭容器中进行的,测得某一时刻体系内 的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率
的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率_______ (填“>”“<”或“=”)CH3OH的消耗速率。
④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是_______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。
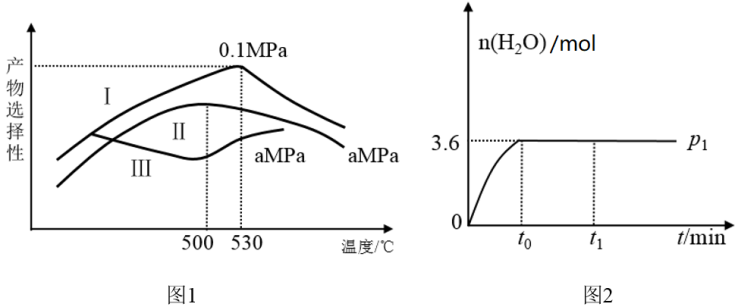
①为尽可能的获得乙烯,控制的生产条件为_______
②一定温度下某密闭容器中存在反应: 。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为_______ (保留三位有效数字)。
反应1(主):
反应2(副):
温度高于300C则会同时发生反应3:
(1)反应1能够自发进行的原因是
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| I. | 2.0 | 0.2 |
| II. | 1.0 | 2.3 |
| III. | K3 | 4.6 |
①反应I的平衡常数表达式K1=
②b
③K3=
④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。

①为尽可能的获得乙烯,控制的生产条件为
②一定温度下某密闭容器中存在反应:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网