解答题-原理综合题 较难0.4 引用2 组卷298
含氮物质被广泛应用于化肥、制药、合成纤维等化工行业造福人类,但如果使用或处理不当,也会对环境造成影响。如何合理地使用含氮物质,是化学学科肩负的重要社会责任。请根据所学知识解答下列问题:
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ:
Ⅱ.
则CH4将NO还原为N2的热化学方程式为____________________________ 。
(2)在 密闭容器中通入
密闭容器中通入 和
和 ,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(p)的数据见下表:
,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(p)的数据见下表:
由表中数据计算, 内
内
_________  ,该温度下的浓度平衡常数
,该温度下的浓度平衡常数
___________ 。
(3)在一密闭的恒容容器中,若按 投料进行反应Ⅱ,下列说法正确的是
投料进行反应Ⅱ,下列说法正确的是_______ 。
A.使用催化剂可以提高CH4的平衡转化率
B.若反应Ⅱ在400℃和500℃的平衡常数分别为Ka和Kb,则Ka>Kb
C.投料比不变,温度越低,反应一定时间后CH4的转化率越高
D.投料比不变,增加反应物的浓度,达到新平衡后CH4的转化率减小
E.若 ,说明反应达到平衡状态
,说明反应达到平衡状态
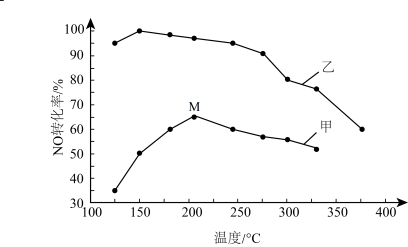
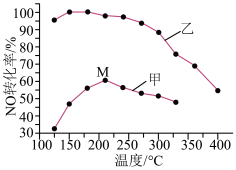
(4)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为: 。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
①工业上选择催化剂__________ (填“甲”或“乙”)
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是_______ (写一条即可)。
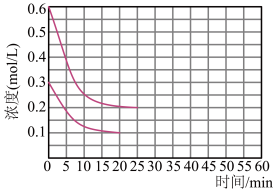
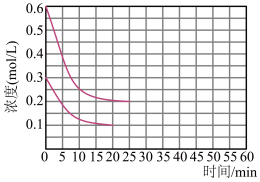
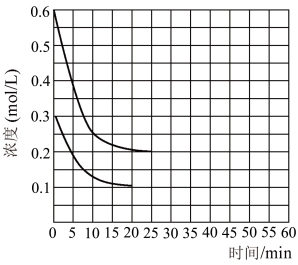
(5)工业合成尿素的反应如下: ,在恒定温度下,将NH3和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经
,在恒定温度下,将NH3和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经 达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1molCO2,在40min时重新达到平衡,请在图中画出
达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1molCO2,在40min时重新达到平衡,请在图中画出 内NH3的浓度变化曲线。
内NH3的浓度变化曲线。__________ 。
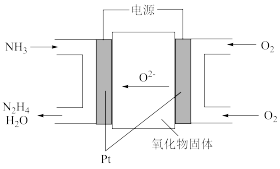
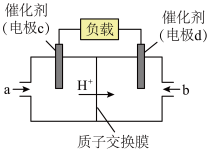
(6)工业上利用NH3进一步制备联氨(N2H4)等。有学者探究用电解法制备的效率,装置如图。试写出其阳极电极反应式_________ 。
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ:
Ⅱ.
则CH4将NO还原为N2的热化学方程式为
(2)在
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算,
(3)在一密闭的恒容容器中,若按
A.使用催化剂可以提高CH4的平衡转化率
B.若反应Ⅱ在400℃和500℃的平衡常数分别为Ka和Kb,则Ka>Kb
C.投料比不变,温度越低,反应一定时间后CH4的转化率越高
D.投料比不变,增加反应物的浓度,达到新平衡后CH4的转化率减小
E.若
(4)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:

①工业上选择催化剂
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是
(5)工业合成尿素的反应如下:


(6)工业上利用NH3进一步制备联氨(N2H4)等。有学者探究用电解法制备的效率,装置如图。试写出其阳极电极反应式
19-20高二·浙江·期末
类题推荐
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为我国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:





若某反应的平衡常数表达式为 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2)在一定条件下可发生分解反应: ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
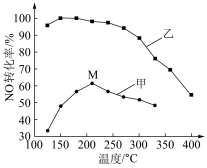
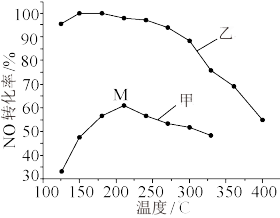
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:
 。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
①工业上选择催化剂_______ (填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是_______ 。
(4)工业合成尿素的反应如下:
 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25 min时再向容器中充入2 mol的
按2∶1的物质的量之比充入一体积为10 L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20 min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25 min时再向容器中充入2 mol的 和1 mol
和1 mol  ,在40 min时重新达到平衡,请在图中画出25~50 min内
,在40 min时重新达到平衡,请在图中画出25~50 min内 的浓度变化曲线
的浓度变化曲线_____ 。
(5) 和
和 组合形成的燃料电池的结构如图所示,质子(
组合形成的燃料电池的结构如图所示,质子( )交换膜左右两侧的溶液均为1 L 2 mol/L的
)交换膜左右两侧的溶液均为1 L 2 mol/L的 溶液。电极c是
溶液。电极c是_______ (填“正”或“负”)极,写出物质a在电极c上发生的反应式为_______ 。
(1)已知:
若某反应的平衡常数表达式为
(2)在一定条件下可发生分解反应:
| A. | B.容器中压强不再变化 |
| C. | D.气体的密度保持不变 |

①工业上选择催化剂
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是
(4)工业合成尿素的反应如下:

(5)

“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为我国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:





若某反应的平衡常数表达式为 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2)在一定条件下可发生分解反应: ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:
 。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
①工业上选择催化剂_______ (填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是_______ 。
(4)工业合成尿素的反应如下:
 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的
按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的 和1mol
和1mol ,在40min时重新达到平衡,请在图中画出25~50min内
,在40min时重新达到平衡,请在图中画出25~50min内 的浓度变化曲线。
的浓度变化曲线。_______ 。
(1)已知:
若某反应的平衡常数表达式为
(2)在一定条件下可发生分解反应:
| A. | B.容器中压强不再变化 |
| C. | D.气体的密度保持不变 |

①工业上选择催化剂
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是
(4)工业合成尿素的反应如下:

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网