解答题-原理综合题 适中0.65 引用2 组卷187
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
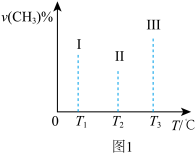
I.(1)已知:一定条件下 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:

①此反应的化学平衡常数表达式为______
②在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中加入足量 ,然后分别充入amol
,然后分别充入amol  ,三个容器的反应温度分别为
,三个容器的反应温度分别为 、
、 、
、 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时 的体积分数如图1所示,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是
的体积分数如图1所示,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是______ ;上述反应的
______  填“大于”或“小于”
填“大于”或“小于” ,该反应在
,该反应在______  填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度” 下可自发进行。
下可自发进行。
Ⅱ.利用天然气为原料的一种工业合成氨简式流程图如图2:
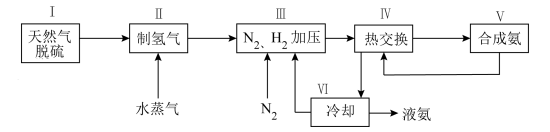
图2
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ ;
;
Ⅱ ;
;
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______ 。
A.单位时间内 1mol 消耗,同时有 3mol
消耗,同时有 3mol  生成;
生成;
B. 、
、 、CO 的物质的量浓度相等;
、CO 的物质的量浓度相等;
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应 ;
;
______  用含
用含  、
、 的代数式表示
的代数式表示 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为: 在容积为 10L 的密闭容器中进行,起始时充入 0.2molN2、0.6mol H2反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
在容积为 10L 的密闭容器中进行,起始时充入 0.2molN2、0.6mol H2反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。

图3
①实验 a 从开始至平衡时的反应速率
______ ;实验 c 中 N2的平衡转化率  为
为______ 。
②与实验 a 相比,其他两组改变的实验条件是:b______ ,c______ 。
③M点的逆反应速率
______ N点的正反应速率 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;N点时再加入一定量NH3,平衡后H2的体积分数
;N点时再加入一定量NH3,平衡后H2的体积分数______ 填“增大”、“减小”或“不变” 。
。

I.(1)已知:一定条件下
①此反应的化学平衡常数表达式为
②在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中加入足量
Ⅱ.利用天然气为原料的一种工业合成氨简式流程图如图2:

图2
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ
Ⅱ
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是
A.单位时间内 1mol
B.
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:

图3
①实验 a 从开始至平衡时的反应速率
②与实验 a 相比,其他两组改变的实验条件是:b
③M点的逆反应速率
2020高三·全国·专题练习
类题推荐
Ⅰ.已知:①
 ;
;
②

(1)Al和FeO发生铝热反应的热化学方程式是_______ 。
(2)据报道,科学家在一定条件下利用 与甲烷反应可制取“纳米级”的金属铁。其反应为:
与甲烷反应可制取“纳米级”的金属铁。其反应为:

①若反应在5L的密闭容器中进行,1min后达到平衡,测得 在反应中质量减少3.2g。则该段时间内CO的平均反应速率为
在反应中质量减少3.2g。则该段时间内CO的平均反应速率为_______ 。
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是_______ 。
A. 的转化率等于CO的产率 B.混合气体的密度不变
的转化率等于CO的产率 B.混合气体的密度不变
C. 与
与 的比值为1∶2 D.固体的总质量不变
的比值为1∶2 D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由 升高到
升高到 时,平衡常数
时,平衡常数
_______  (填“>”、“<”或“=”);以下选项中纵坐标可以表示的物理量有
(填“>”、“<”或“=”);以下选项中纵坐标可以表示的物理量有_______ 。
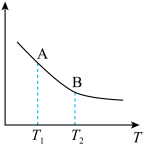
A. 的逆反应速率 B.
的逆反应速率 B. 的的体积分数
的的体积分数
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知
 ,在一个有催化剂的容积不变的密闭容器中加入
,在一个有催化剂的容积不变的密闭容器中加入 和
和 。在500℃时充分反应,达平衡后
。在500℃时充分反应,达平衡后 的浓度为
的浓度为 ,放出热量为
,放出热量为 。
。
(3)下列措施可以同时提高反应速率和 的转化率是_______。
的转化率是_______。
(4)达到平衡时, 的转化率为
的转化率为_______ (用 、
、 表示)。
表示)。
(5)将上述容器改为恒压容器,起始时加入 和
和 ,500℃时充分反应达平衡后,放出热量
,500℃时充分反应达平衡后,放出热量 ,则
,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(6)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_______。
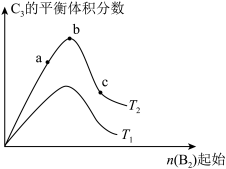
②
(1)Al和FeO发生铝热反应的热化学方程式是
(2)据报道,科学家在一定条件下利用
①若反应在5L的密闭容器中进行,1min后达到平衡,测得
②若该反应在恒温恒容容器中进行,能表明该反应达到平衡状态的是
A.
C.
③该反应达到平衡时某物理量随温度变化如图所示,当温度由

A.
C.混合气体的平均相对分子质量 D.CO的体积分数
Ⅱ.已知
(3)下列措施可以同时提高反应速率和
| A.选择适当的催化剂 | B.增大压强 |
| C.及时分离生成的 | D.升高温度 |
(5)将上述容器改为恒压容器,起始时加入
(6)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_______。

| A.反应速率c>b>a | B.达到平衡时 |
| C. | D.b点 |
NH3是一种重要的化工原料,工业上用 H2、N2合成。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=______ ,此温度下该反应平衡常数 K=_____ 。该温度下在此容器中加入 3molCO 和 1molH2O(g)发生上述反应,达到平衡后放出热 量_____ 20.5kJ(填“>”、“=”或“<”)。
②已知不同反应物投料比( )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越________ (填“大”或“小”); 请推测随反应物投料比增大,H2O的平衡转化率的变化趋势是______ (填字母)。
A.增大 B.减小 C.先减小后增大 D.先增大后减小
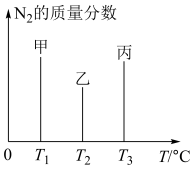
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是_____ ,都达到平衡状态时,N2转化率最低的是________ 。(用“甲”、“乙”、“丙”填空)
(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
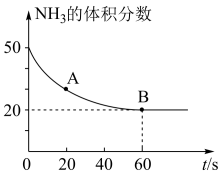
A 点的逆反应速率V逆(CO2)_____ B 点的正反应速率 V正(CO2)(填“>”、 “=”或“<”);NH3的平衡转化率为____________ 。
(4)已知 NH2COONH4(s) 2NH3(g)+CO2(g),若将一定量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1
2NH3(g)+CO2(g),若将一定量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________ P2, ρ1_____________________ ρ2(填“>”、“=”或“<”)。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=
②已知不同反应物投料比(
 )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:| 温度(℃)\投料比 | 1 | 3 | 5 |
| 200℃ | 0.70 | 0.21 | 0.02 |
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越
A.增大 B.减小 C.先减小后增大 D.先增大后减小
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是

(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
A 点的逆反应速率V逆(CO2)
(4)已知 NH2COONH4(s)
 2NH3(g)+CO2(g),若将一定量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1
2NH3(g)+CO2(g),若将一定量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




