解答题-实验探究题 适中0.65 引用1 组卷77
铜是一种古老而又年轻的金属元素,铜及其化合物在生产生活中有着广泛的应用。
(1)古代留下来的青铜器表面呈绿色,原因是在潮湿的空气中,铜易发生腐蚀生成铜绿,有关反应的化学方程式为______ 。
(2)现代工业主要采用高温冶炼黄铜矿 ,也可表示为
,也可表示为 的方法获得铜。火法炼铜首先要焙烧黄铜矿:
的方法获得铜。火法炼铜首先要焙烧黄铜矿: ,每转移0.6mol电子,有
,每转移0.6mol电子,有______ mol硫原子被氧化。写出火法炼铜由 得到Cu的总方程式
得到Cu的总方程式______ 。
(3) 可用于游泳池水的消毒,原因是
可用于游泳池水的消毒,原因是______ 。
(4)向 和
和 的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为
的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为______ (已知 ,
, )。
)。
(5)利用Cu和 溶液的反应可制作印刷线路板,为了从含有
溶液的反应可制作印刷线路板,为了从含有 、
、 、
、 的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
方案1:向废液中加入过量铁粉,充分反应后过滤。在所得滤渣中加入足量盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为______ 。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时Cu已全部析出,在电极上可直接回收铜。操作比方案1简便,但方案2也有不足之处,主要表现为______ 。
(1)古代留下来的青铜器表面呈绿色,原因是在潮湿的空气中,铜易发生腐蚀生成铜绿,有关反应的化学方程式为
(2)现代工业主要采用高温冶炼黄铜矿
(3)
(4)向
(5)利用Cu和
方案1:向废液中加入过量铁粉,充分反应后过滤。在所得滤渣中加入足量盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时Cu已全部析出,在电极上可直接回收铜。操作比方案1简便,但方案2也有不足之处,主要表现为
2020高三·全国·专题练习
类题推荐
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl2足量时生成 FeCl3,当铁粉过量时产物是FeCl2 。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。
探究过程如下:
提出假设:A是FeCl3,B是FeCl2 。
(1)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
(2)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式____________________ 。
(3)为进一步探究 FeCl3溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____ (填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeCl3固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为_____________________ 。
方案2:在废液中加入适量的盐酸调节溶液的 pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________ 极,该电极上所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)____________________ 。
方案2在电极上直接回收铜,操作上比方案 1简便,但方案 2 也有不足之处,主要表现为____ 。
探究过程如下:
提出假设:A是FeCl3,B是FeCl2 。
(1)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
(2)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式
(3)为进一步探究 FeCl3溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeCl3固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为
方案2:在废液中加入适量的盐酸调节溶液的 pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作
方案2在电极上直接回收铜,操作上比方案 1简便,但方案 2 也有不足之处,主要表现为
某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成分、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气

写出A、B中所盛放最佳化学试剂的名称_________ 、__________ ,画出虚线框内所需装置图并标明所需试剂的名称_________ 。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:_________ ;假设③:_________ 。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
由此得出结论:假设_______ 成立(填序号①②③)。
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_________ (填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式___________ 。活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下:
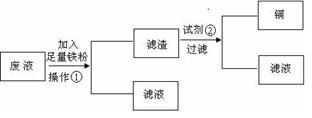
请分别写出操作①和试剂②的名称_________ ,_______ 。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作________ 极。当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出。
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:______________ 。
Ⅰ、用下列实验装置制取纯净干燥的氯气

写出A、B中所盛放最佳化学试剂的名称
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加酸性KMnO4溶液 | KMnO4溶液紫色不褪色 | 固体物质中不含 |
由此得出结论:假设
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式
方案1:设计流程图如下:

请分别写出操作①和试剂②的名称
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


