解答题-实验探究题 适中0.65 引用1 组卷96
室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
(1)实验Ⅰ中生成的无色无味气体的主要成分是________ ,产生原因是_________ (用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________ 。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________ 。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______ 。残余固体加入浓硝酸时,反应的化学方程式是________ 。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜【Cu2(OH)2SO4】是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是【Cu2(OH)2SO4】;
ii.是Cu(OH)2和【Cu2(OH)2SO4】的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________ 。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________ 有关。
| 实验 | 操作 | 实验现象 |
| Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2) | 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
| Ⅱ |  4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
| Ⅲ | 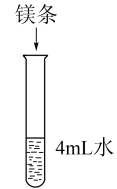 | 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
| 实验 | 操作 | 实验现象 |
Ⅳ | 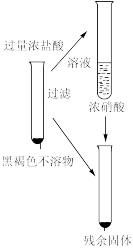 | 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜【Cu2(OH)2SO4】是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是【Cu2(OH)2SO4】;
ii.是Cu(OH)2和【Cu2(OH)2SO4】的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与
18-19高三·北京顺义·期末
类题推荐
某小组同学为探究FeCl3溶液与Mg的反应,设计并完成了如下实验。
(1)产生的气体是_______ 。
(2)开始反应后,立即检测到溶液中含有Fe2+的原因是_______ (用离子方程式表示)。
(3)生成的红褐色沉淀是_______ 。
(4)反应后,最终溶液呈无色。甲同学认为上层清液中仍然可能存在Fe2+,并设计如下方案:取上层清液于试管中,滴加酸性KMnO4溶液,若紫色褪去,则说明上层清液中含有Fe2+。乙同学认为该方案不合理,其理由是_______ 。最终乙同学利用Fe2+的特征反应证实了溶液中存在Fe2+。
(5)已知Fe和Fe3O4都能被磁铁吸引,分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.将黑色固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅲ.向ⅱ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是_______ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是_______ 。
| 操作 | 现象及产物检验 |
 5mL 0.5mol﹒L-1 FeCl3溶液[pH约为1,即c(H+)=0.1mol﹒L-1] | 立即产生大量气泡,液体颜色由黄色逐渐变为红褐色,此时检测到溶液中存在Fe2+,镁条表面仍为光亮的银白色;一段时间后,底部有红褐色沉淀,溶液颜色接近无色,金属表面产生大量黑色固体 |
(2)开始反应后,立即检测到溶液中含有Fe2+的原因是
(3)生成的红褐色沉淀是
(4)反应后,最终溶液呈无色。甲同学认为上层清液中仍然可能存在Fe2+,并设计如下方案:取上层清液于试管中,滴加酸性KMnO4溶液,若紫色褪去,则说明上层清液中含有Fe2+。乙同学认为该方案不合理,其理由是
(5)已知Fe和Fe3O4都能被磁铁吸引,分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.将黑色固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅲ.向ⅱ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是
探究0.5mol/L FeCl3溶液(pH=1)与不同金属反应时的多样性的原因。 (各组实验中:所用FeCl3溶液体积相同;金属过量;静置、不振荡)
(1)根据实验I的现象,推测红褐色液体为胶体,并用光束照射该液体,在与光束垂直的方向观察到_________ 得以证实。
(2)已知Fe和Fe3O4均能被磁铁吸引。
①为了确定黑色固体的成分是否含有Fe和Fe3O4,重复实验I,及时取少量镁条表面生成的黑色粉末,洗净后进行实验如下:
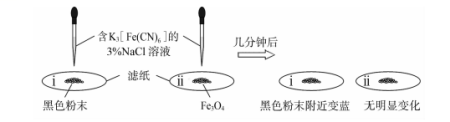
该实验说明黑色固体中一定含有_________ ,结合现象写出判断的理由_________ 。
②除上述结论外,分析实验I的现象,可知被还原得到的产物一定还有_________ 。
(3)实验Ⅰ、Ⅱ现象的差异,与Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性强弱有关,其顺序是Mg2+<Fe2+<_________ 。
(4)继续研究0.5mol/L FeCl3溶液(pH=1)与Fe的反应。
①实验Ⅲ中发生反应的离子方程式有_________ 。
②已知:相同条件下,H+在溶液中的移动速率远大于Fe3+。 结合实验I、Ⅱ,由反应中金属表面离子浓度的变化,推测实验III、IV现象差异的原因:_________ 。
| 实验 | 金属 | 现象及产物检验 |
| I | 镁条 | 立即产生大量气体;金属表面变黑,该黑色固体能被磁铁吸引;液体颜 色由棕黄色逐渐变为红褐色;片刻后气泡减少;金属表面覆盖有红褐色沉淀,此时取反应后的液体, 滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
| II | 铜粉 | 无气体产生;溶液逐渐变为蓝绿色;取反应后的溶液,滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
(1)根据实验I的现象,推测红褐色液体为胶体,并用光束照射该液体,在与光束垂直的方向观察到
(2)已知Fe和Fe3O4均能被磁铁吸引。
①为了确定黑色固体的成分是否含有Fe和Fe3O4,重复实验I,及时取少量镁条表面生成的黑色粉末,洗净后进行实验如下:

该实验说明黑色固体中一定含有
②除上述结论外,分析实验I的现象,可知被还原得到的产物一定还有
(3)实验Ⅰ、Ⅱ现象的差异,与Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性强弱有关,其顺序是Mg2+<Fe2+<
(4)继续研究0.5mol/L FeCl3溶液(pH=1)与Fe的反应。
| 实验 | 金属 | 现象及产物检验 |
| Ⅲ | 铁粉 | 持续产生少量气体;一段时间后,溶液颜色变浅,底部有红褐色沉 淀,经检验,溶液pH=4;含有Fe2+,无Fe3+。 |
| Ⅳ | 铁丝 | 无明显的气泡产生;一段时间后,溶液变为浅绿色,经检验,溶液 pH=2,含有Fe2+和Fe3+;Fe3+被还原的量多于实验Ⅲ。 |
①实验Ⅲ中发生反应的离子方程式有
②已知:相同条件下,H+在溶液中的移动速率远大于Fe3+。 结合实验I、Ⅱ,由反应中金属表面离子浓度的变化,推测实验III、IV现象差异的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


