解答题-原理综合题 较难0.4 引用1 组卷62
已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A原子最外层电子数是次外层电子数的2倍,C是地壳中含量最多的元素,D是短周期原子半径最大的元素,E原子最外层电子数与C原子最外层电子数相等。回答下列问题:
(1)C元素在周期表中的位置是______________ 。
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因_______ 。
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是________ 。
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是_________ 。
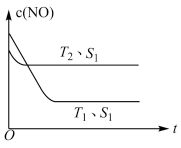
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H____ 0 (填“>”或“<”)。
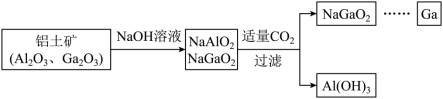
(6)实验室制取F的单质时,常含有少量HCl气体,可用_________ (试剂)除去HCl,请用平衡移动的原理解释原因:________ 。
(1)C元素在周期表中的位置是
(2)从原子结构的角度解释最高价氧化物对应的水化物的酸性F的大于E的原因
(3)E元素的低价氧化物与D元素的最高价氧化物对应的水化物反应生成的酸式盐,溶于水,溶液中所有离子由大到小的排列顺序是
(4)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO (g)=N2 (g) + O2 (g) △H=﹣180.5kJ•mol﹣1
2H2O (l)=2H2 (g) + O2 (g) △H= + 571.6kJ•mol﹣1
则H2 (g)与NO (g)反应生成N2 (g)和H2O (l)的热化学方程式是
(5)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应2NO (g) + 2CO(g)⇌2CO2 (g) + N2 (g)中,NO的浓度c (NO)随温度 (T)、催化剂表面积 (S)和时间 (t)的变化曲线。该反应的△H

(6)实验室制取F的单质时,常含有少量HCl气体,可用
19-20高三·北京石景山·阶段练习
类题推荐
已知A、B、C、D、E、F、G、H为原子序数依次增大的主族元素,其中D与G同族,且D为短周期主族元素中原子半径最大的元素,C的最外层电子数是其次外层电子数的3倍。A、B、C、E、F、H在元素周期表中的相对位置如图,请回答下列问题:
(1)已知元素H的一种核素的中子数为45,请用原子符号表示该核素:_______ 。
(2)D单质与C单质在不同条件下可生成不同物质,请用电子式表示D和C的原子形成的白色固体的过程:_______ 。D和C组成的淡黄色固体物质所含的化学键类型有_______ (填“离子键”、“极性键”或“非极性键”)。
(3)为确定 中是否含有
中是否含有 ,可使用的鉴别方法为
,可使用的鉴别方法为_______ 。
(4)元素E,F,G的简单离子半径由大到小的顺序是_______ (用离子符号表示);
(5)比较元素E和F的非金属性强弱:在E的氢化物的水溶液中通入少量F的单质,写出发生反应的化学方程式:_______ 。从原子结构角度解释E和F的非金属性差异的原因:_______ 。
(6)依据元素在周期表中的位置可以推测元素性质:
①硒( )位于第四周期,与E同主族。下列推断正确的是
)位于第四周期,与E同主族。下列推断正确的是_______ 。
a. 只具有还原性
只具有还原性
b. 的最高价含氧酸的酸性弱于H的最高价含氧酸
的最高价含氧酸的酸性弱于H的最高价含氧酸
c. 的气态氢化物的稳定性比E的强
的气态氢化物的稳定性比E的强
d. 的最低负化合价是
的最低负化合价是 价
价
②锡为主族元素,其原子结构示意图: 。锡在元素周期表中的位置是
。锡在元素周期表中的位置是_______ , 能与
能与 溶液反应生成钠盐,写出发生反应的化学方程式:
溶液反应生成钠盐,写出发生反应的化学方程式:_______ 。
| A | B | C | |
| E | F | ||
| H | |||
(2)D单质与C单质在不同条件下可生成不同物质,请用电子式表示D和C的原子形成的白色固体的过程:
(3)为确定
(4)元素E,F,G的简单离子半径由大到小的顺序是
(5)比较元素E和F的非金属性强弱:在E的氢化物的水溶液中通入少量F的单质,写出发生反应的化学方程式:
(6)依据元素在周期表中的位置可以推测元素性质:
①硒(
a.
b.
c.
d.
②锡为主族元素,其原子结构示意图:
 。锡在元素周期表中的位置是
。锡在元素周期表中的位置是 主族元素A、B、C、D、E、F、G、H在元素周期表中的相对位置如图所示。已知上述8种元素的原子最外层电子数之和等于47,C与H的质子数之和为43.请回答下列问题:
(1)G在元素周期表中位于第_____ 周期第_____ 族。
(2)在C、D、G的最简单氢化物中,最不稳定的是_____ (填化学式),常温下,B的最简单氢化物的水溶液的pH_____ (填“>”、“<”或“=”)7.
(3)单质A_____ (填“能”或“不能”)与B的最高价氧化物对应的水化物的浓溶液发生反应。
(4)E的简单氢化物通入胆矾溶液中,产物含红色单质和两种最高价含氧酸,该反应的离子方程式为_____ 。
(5)3molF单质通入热KOH溶液中完全反应,共转移5mol电子。在该反应中,氧化剂与还原剂的质量之比为_____ 。
(6)一定条件下,AC、BC和熔盐(能传导 )能形成原电池(产物为无污染气体),其中负极通入的是
)能形成原电池(产物为无污染气体),其中负极通入的是_____ (填化学式),正极的电极反应为_____ 。
| A | B | C | D |
| E | F | ||
| G | H |
(2)在C、D、G的最简单氢化物中,最不稳定的是
(3)单质A
(4)E的简单氢化物通入胆矾溶液中,产物含红色单质和两种最高价含氧酸,该反应的离子方程式为
(5)3molF单质通入热KOH溶液中完全反应,共转移5mol电子。在该反应中,氧化剂与还原剂的质量之比为
(6)一定条件下,AC、BC和熔盐(能传导
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网