解答题-原理综合题 适中0.65 引用1 组卷99
人类的生存与发展都和能源有密切关系,其中煤炭的能源利用是人类最早开发的能源之一。在现代化工业中,煤炭的气化是以煤炭为原料,在高温高压下使煤炭中的有机物质和气化剂发生一系列的化学反应,使固体的煤炭转化成可燃性气体的生产过程。生要反应如下:
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是___ ;∆H4=___ kJ·mol-1。
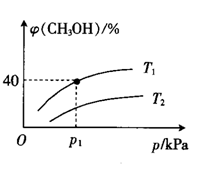
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:
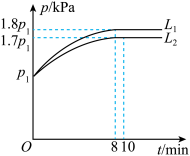
①图中代表恒温容器的曲线是___ (填“L1,"或“L2”)。
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=__ mol·L-1·min-1。
③恒温容器中,T°C时,该反应的平衡常数Kp=__ kPa(Kp是以分压表示的平衡常数,分压=总压×物质的量分数。用含P1的代数式表示)
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是__ (填序号)。
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
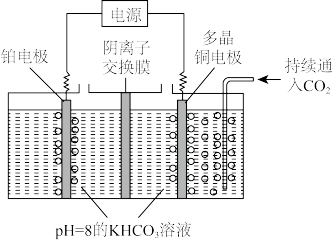
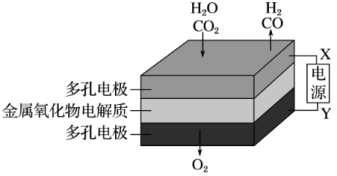
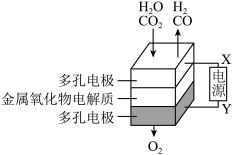
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的___ 极,阴极的电极反应式有:__ 。
Ⅰ.C(s)+CO2(g)=2CO(g) ∆H1=+172.8kJ·mol-1
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g) ∆H2=+131.8kJ·mol-1
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ∆H3=-41.0kJ·mol-1
Ⅳ.C(s)+2H2O(g)=CO2(g)+2H2(g) ∆H4
回答下列问题:
(1)CO2的电子式是
(2)分别向初始温度为T℃,体职为2L的两个刚性密闭容器中,各充入足量的C(a)和1molH2O(g),一个容器为恒温容器,一个容器为绝热容器,若只发生反应II。两容器中压强随时间的变化关系如图所示:

①图中代表恒温容器的曲线是
②绝热容器中,从反应开始至达到平衡,平均反应速率v(H2O)=
③恒温容器中,T°C时,该反应的平衡常数Kp=
(3)若在恒温容器中,同时发生以上四个反应,其中C(s)足量。下列说法正确的是
a.当CO浓度不再发生变化时,容器中所有反应均达到平衡状态
b.缩小容器容积,反应I正反应速率降低,逆反应速率升高,平衡初逆方向移动
c.根据平衡常数公式,若从密闭容器中分离出所有C(s),各气体的浓度保持不变
(4)煤炭是不可再生资源,而在固态金属氧化物电解池中,高温电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。X是电源的

19-20高三上·云南昆明·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网