填空题 适中0.65 引用1 组卷392
工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=﹣49.6kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H2=+41kJ•mol-1
(1)反应Ⅰ在___ (填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___ 。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
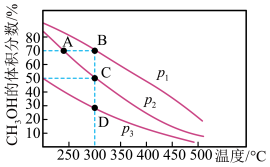
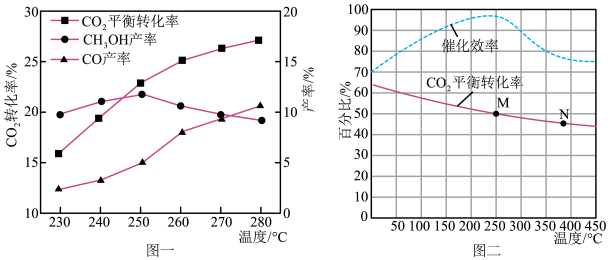
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。
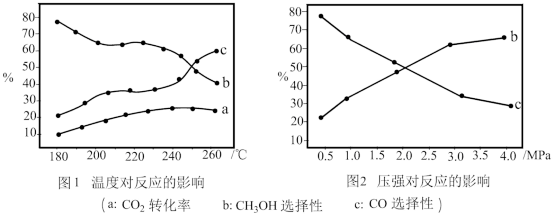
①下列说法正确的是___ 。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___ 。
③分析图2中CO选择性下降的原因___ 。
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=﹣49.6kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H2=+41kJ•mol-1
(1)反应Ⅰ在
(2)有利于提高上述反应甲醇平衡产率的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为
③分析图2中CO选择性下降的原因
2019·浙江·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网