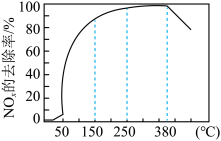
解答题-原理综合题 较难0.4 引用1 组卷112
环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物 的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为
的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______ 。
(2)使用稀土催化剂有效消除汽车尾气中的 、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将
、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将 、
、 转化成无毒物质,相关反应为:
转化成无毒物质,相关反应为:
①
②
③
则
______ (用 和
和 表示)。
表示)。
(3)实验室在恒压下,将 和
和 置于密闭容器中发生反应③,测得在不同温度、不同投料比时,
置于密闭容器中发生反应③,测得在不同温度、不同投料比时, 的平衡转化率如下表:
的平衡转化率如下表:
①在 与
与 反应时,可提高
反应时,可提高 转化率的措施有
转化率的措施有 ______ 填编号 。
。
A 增加催化剂的表面积 改用高效催化剂
改用高效催化剂  降低温度
降低温度
D 增大压强 分离出
分离出
 减小
减小
② 时,将投料比为1的
时,将投料比为1的 和
和 的混合气体共
的混合气体共 ,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数
,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______ 。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出 内,容器中
内,容器中 物质的量浓度c随时间变化的曲线图
物质的量浓度c随时间变化的曲线图______ 。
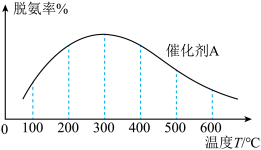
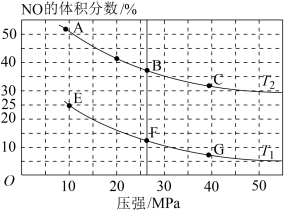
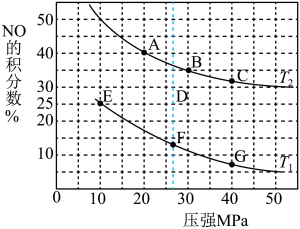
(4)SNCR是一种新型的烟气脱氮环保技术,在有氧条件下,其脱氮原理是: 和
和 在
在 催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是
催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是 回答两条
回答两条 :
: ______ 。
(1)连续自动监测氮氧化物

(2)使用稀土催化剂有效消除汽车尾气中的
①
②
③
则
(3)实验室在恒压下,将
| 投料比 | 400K | 500K | 600K |
| 1 | |||
| 2 |
①在
A 增加催化剂的表面积
D 增大压强
②
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出
(4)SNCR是一种新型的烟气脱氮环保技术,在有氧条件下,其脱氮原理是:
2020高三·全国·专题练习
类题推荐
研究脱除烟气中的NO是环境保护、促进社会可持续发展的重要课题。回答下列问题:
I.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒、无害的气体: ,可减少尾气中的有害气体排放。已知该反应的
,可减少尾气中的有害气体排放。已知该反应的 (
( 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
(1)已知:碳的燃烧热为 ;
;
 ;
;
 ;
;
则反应

___________ 。若平衡后升高温度,则
___________ (填“增大”“不变”或“减小”)。
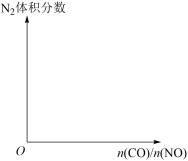
(2)将CO和NO按不同比例投入一密闭容器中,控制一定温度( 或
或 ),发生反应并达到平衡时,所得的混合气体中
),发生反应并达到平衡时,所得的混合气体中 的体积分数随
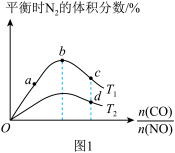
的体积分数随 的变化曲线如图1所示。图1中a、b、c、d中对应的NO的转化率最大的是
的变化曲线如图1所示。图1中a、b、c、d中对应的NO的转化率最大的是___________ (填序号)。
Ⅱ. 还原NO:一定温度下,在2L密闭容器中通入
还原NO:一定温度下,在2L密闭容器中通入
 和
和 ,在
,在 时,发生反应:
时,发生反应:
 ,反应时间(t)与NO的物质的量
,反应时间(t)与NO的物质的量 的关系如下表:
的关系如下表:
(3)由表中数据计算, 内
内
___________  ,该温度下的压强平衡常数
,该温度下的压强平衡常数
___________ (用分压表示,分压=物质的量分数×总压)。下列措施中,可以作为反应达到平衡的判据的是___________ (填序号)。
a.气体的压强不变 b. c.气体的密度不变
c.气体的密度不变
d.K不变 e. 的质量保持不变 f.反应物不再转化为生成物
的质量保持不变 f.反应物不再转化为生成物
Ⅲ.近年来,低温等离子技术是在高压放电下, 产生
产生 自由基,
自由基, 自由基将NO氧化为
自由基将NO氧化为 后,再用
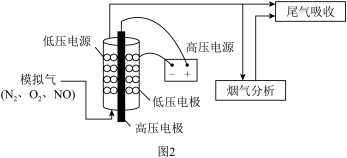
后,再用 溶液吸收,达到消除NO的目的。实验室将模拟气(
溶液吸收,达到消除NO的目的。实验室将模拟气( 、NO)以一定流速通入低温等离子体装置,实验装置如图2所示。
、NO)以一定流速通入低温等离子体装置,实验装置如图2所示。
(4)等离子体技术在低温条件下可提高NO的转化率,原因是___________ 。
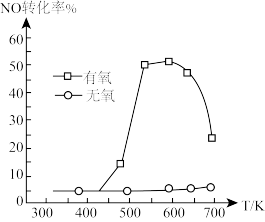
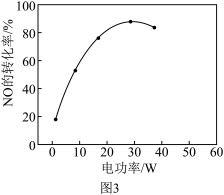
(5)其他条件相同,等离子体的电功率与NO的转化率的关系如图3所示,当电功率大于30W时,NO的转化率下降的原因可能是___________ 。
Ⅳ.除上述方法外,还可用电解法将NO转变为 ,其工作原理如图4。
,其工作原理如图4。
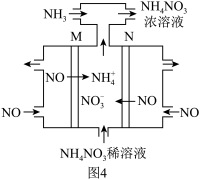
(6)N极的电极反应式为___________ 。
I.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒、无害的气体:
(1)已知:碳的燃烧热为
则反应
(2)将CO和NO按不同比例投入一密闭容器中,控制一定温度(

Ⅱ.
| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 2.00 | 1.20 | 0.80 | 0.60 | 0.50 | 0.50 |
(3)由表中数据计算,
a.气体的压强不变 b.
d.K不变 e.
Ⅲ.近年来,低温等离子技术是在高压放电下,

(4)等离子体技术在低温条件下可提高NO的转化率,原因是
(5)其他条件相同,等离子体的电功率与NO的转化率的关系如图3所示,当电功率大于30W时,NO的转化率下降的原因可能是

Ⅳ.除上述方法外,还可用电解法将NO转变为

(6)N极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 N2(g)+2CO2(g),ΔH
N2(g)+2CO2(g),ΔH