解答题-原理综合题 适中0.65 引用1 组卷53
氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
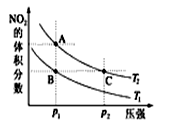
(1)①已知4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) △H=-1200kJ⋅mol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是___ (填代号)。

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-QkJ⋅mol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为___ ;乙容器吸收的热量为___ 。
(2)氨水常用作沉淀剂,已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Al(OH)3]=1.1×10-33,向浓度均为0.1mol⋅L-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是___ (填化学式)。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ⋅mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ⋅mol-1
写出肼与四氧化二氮反应的热化学方程式___ 。
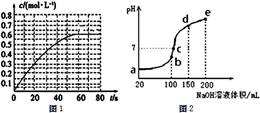
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1mol⋅L-1NaOH溶液中加入0.2mol⋅L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。

①根据图象写出HN3的电离方程式:___ 。
②下列说法正确的是___ (填序号)。
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2mol⋅L-1HN3的溶液中加水稀释,则 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1mol⋅L-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
(1)①已知4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) △H=-1200kJ⋅mol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-QkJ⋅mol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为
| 甲 | 乙 |
| 0.10molH2O | 0.20molH2 |
| 0.10molCO | 0.20molCO2 |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ⋅mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ⋅mol-1
写出肼与四氧化二氮反应的热化学方程式
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1mol⋅L-1NaOH溶液中加入0.2mol⋅L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。

①根据图象写出HN3的电离方程式:
②下列说法正确的是
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2mol⋅L-1HN3的溶液中加水稀释,则
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1mol⋅L-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
2020高三·全国·专题练习
类题推荐
COS 、H2S是许多煤化工产品的原料气。已知
Ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=X kJ·mol-1;
H2S(g)+CO(g) △H=X kJ·mol-1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1;
(1)断裂1 mol分子中的化学键所需吸收的能量如下表所示:
X=___________ 。
(2)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应,在T10C时达到平衡,体系内CO的体积分数为5%(如下图M点)。
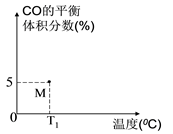
请回答下列问题:
①请在图中画出以M为起点,从T1℃开始升温过程中CO的平衡体积分数随温度变化的曲线。_____
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol,则平衡时H2O的转化率为_________ 。
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M中充入1 mol CO和1 mol H2O,在N中充入1 mol CO2和1 mol H2,均在700 ℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_______ 。
A.容器M、N中正反应速率相同
B.容器M中CO的物质的量比容器N中的多
C.容器M、N中反应的平衡常数相同
D.容器M中CO的转化率与容器N中CO2的转化率之和小于1
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
______________________________________ ;常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL(标况)H2S气体,反应后离子浓度从大到小顺序为_____________________ 。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示:
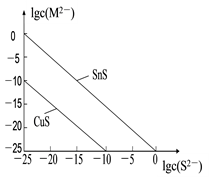
①25℃时Ksp(CuS)=__________________ 。
②25℃时向50.0mL Sn2+、Cu2+浓度均为0.01mol·L-1的混合溶液中逐滴加入Na2S溶液到50.0mL时开始生成SnS沉淀,此时溶液中Cu2+浓度为__________ mol/L。
Ⅰ.COS(g)+H2(g)
 H2S(g)+CO(g) △H=X kJ·mol-1;
H2S(g)+CO(g) △H=X kJ·mol-1;Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) △H =-42 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1;(1)断裂1 mol分子中的化学键所需吸收的能量如下表所示:
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ·mol-1 | 1319 | 442 | 1076 | 678 | 930 | 1606 |
X=
(2)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应,在T10C时达到平衡,体系内CO的体积分数为5%(如下图M点)。
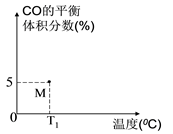
请回答下列问题:
①请在图中画出以M为起点,从T1℃开始升温过程中CO的平衡体积分数随温度变化的曲线。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol,则平衡时H2O的转化率为
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M中充入1 mol CO和1 mol H2O,在N中充入1 mol CO2和1 mol H2,均在700 ℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是
A.容器M、N中正反应速率相同
B.容器M中CO的物质的量比容器N中的多
C.容器M、N中反应的平衡常数相同
D.容器M中CO的转化率与容器N中CO2的转化率之和小于1
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
| H2CO3 | H2S | |
| Ka1 | 4.4×10-7 | 1.3×10-7 |
| Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示:
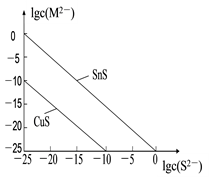
①25℃时Ksp(CuS)=
②25℃时向50.0mL Sn2+、Cu2+浓度均为0.01mol·L-1的混合溶液中逐滴加入Na2S溶液到50.0mL时开始生成SnS沉淀,此时溶液中Cu2+浓度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 N2O4(g)△H=-a kJ•mol-1(a>0)。N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)△H=-a kJ•mol-1(a>0)。N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: