解答题-实验探究题 较难0.4 引用1 组卷455
某兴趣小组在实验室进行如下实验探究活动。
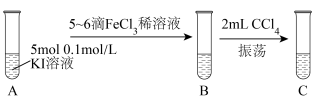
(1)设计如下实验研究2Fe3++2I- 2Fe2++I2的反应。
2Fe2++I2的反应。
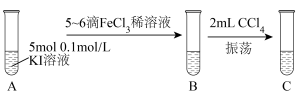
①振荡静置后C中观察到的现象是_______________________ ;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________ (写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________ (答“可以”或“不可以”)
步骤III达到滴定终点的现象是___________________________ 。已知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________ 。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________ ;
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。______________
(1)设计如下实验研究2Fe3++2I-

①振荡静置后C中观察到的现象是
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?
步骤III达到滴定终点的现象是
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。
19-20高二上·四川成都·期末
类题推荐
某化学兴趣小组通过以下实验探究,加深对化学反应速率和化学反应限度的认识,并测定化学反应的平衡常数。
实验一:探究温度和浓度对反应速率的影响
[实验原理及方案]在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
(1)上述表格中:V1=____ mL,V2=____ mL。
(2)酸性溶液中,碘酸钾和亚硫酸钠反应的离子方程式为_____________________________ 。
实验二:探究KI和FeCl3的反应存在一定的限度
[实验步骤]i.向5mL 0.01mol/L KI溶液中滴加5~6滴0.01mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙两等份;
ii.向甲中滴加CCl4,充分振荡; iii.向乙中滴加KSCN溶液。
(3)证明反应存在一定限度的实验现象是:步骤ii中__________________________________ ;步骤iii中___________________________________ 。
实验三:测定反应 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的试剂,振荡半小时。取一定体积的上层清液用标准Na2S2O3溶液进行滴定,测定I2和I 的总浓度。
的总浓度。
(4)不能用普通锥形瓶代替碘量瓶的原因_____ 。
(5)用Na2S2O3溶液滴定上层清液需要选择的指示剂为_____ ,到达滴定终点溶液的颜色变化为__________ 。
(6)0.5g的碘不需要精确称量的理由是:在水中或KI溶液中,_____ ,故I2(aq)浓度不随碘固体的质量增大而增大。
(7)碘量瓶①平衡体系中 与②中
与②中 接近,列出平衡常数K的计算式
接近,列出平衡常数K的计算式____ (只列出计算式即可,不要求计算)。
实验一:探究温度和浓度对反应速率的影响
[实验原理及方案]在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号 | 0.01mol/L KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液的体积/mL | 水的 体积/mL | 实验 温度/℃ | 记录出现蓝色的时间/s |
① | 5 | 5 | V1 | 0 | t1 |
② | 5 | 5 | 40 | 25 | t2 |
③ | 5 | V2 | 35 | 25 | t3 |
(2)酸性溶液中,碘酸钾和亚硫酸钠反应的离子方程式为
实验二:探究KI和FeCl3的反应存在一定的限度
[实验步骤]i.向5mL 0.01mol/L KI溶液中滴加5~6滴0.01mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙两等份;
ii.向甲中滴加CCl4,充分振荡; iii.向乙中滴加KSCN溶液。
(3)证明反应存在一定限度的实验现象是:步骤ii中
实验三:测定反应
常温下,取2个碘量瓶分别加入下表中的试剂,振荡半小时。取一定体积的上层清液用标准Na2S2O3溶液进行滴定,测定I2和I

编号 | 250mL碘量瓶① | 250mL碘量瓶② |
试剂 | 0.5g研细的碘 60mL 0.010 mol/L KI溶液 | 0.5g研细的碘 60mL H2O |
I2和I | 0.00500 mol/L | 0.0012 mol/L |
(5)用Na2S2O3溶液滴定上层清液需要选择的指示剂为
(6)0.5g的碘不需要精确称量的理由是:在水中或KI溶液中,
(7)碘量瓶①平衡体系中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网