解答题-实验探究题 适中0.65 引用1 组卷166
Ⅰ.含氨废水和废气对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4 mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:_____ NO3-+_______ Al+_______ H2O→_______ N2↑+______ Al(OH)3+________ OH-。
(2)上述反应中被还原的元素是____________ ,每生成2 mol N2转移_________ mol电子。
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为_________ g。
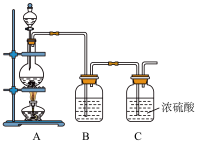
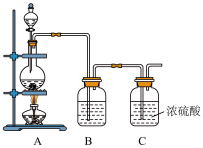
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:
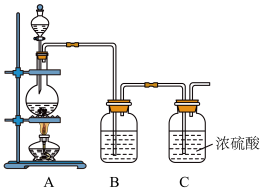
(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_________________________ 。
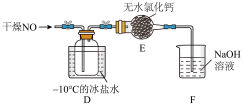
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为__________________________ 。
②如果不用装置E会引起什么后果:__________________ 。
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____________ ,为了充分吸收尾气,可将尾气与________________ 同时通入氢氧化钠溶液中。
(1)配平下列有关离子方程式:
(2)上述反应中被还原的元素是
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:

(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为
②如果不用装置E会引起什么后果:
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为
2019·河北衡水·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网