解答题-实验探究题 适中0.65 引用4 组卷604
绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______ 。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__ 。
②洗涤操作,选用的最佳洗涤试剂是_______ (填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
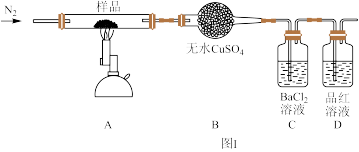
(1)加热前通入氮气的目的是_______ 。
(2)实验中观察到装置B现象为_______ 。
(3)C装置和D装置能否调换_______ (填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______ 。
(5)该装置有个明显缺陷是_______ 。
III.测定绿矾样品中铁元素的含量。
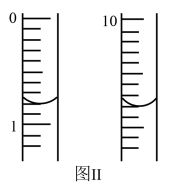
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______ (用含m、c的式子表示)。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
②洗涤操作,选用的最佳洗涤试剂是
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:

(1)加热前通入氮气的目的是
(2)实验中观察到装置B现象为
(3)C装置和D装置能否调换
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是
(5)该装置有个明显缺陷是
III.测定绿矾样品中铁元素的含量。
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为
2020·福建南平·一模
类题推荐
回答下列问题:
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质的性质如下:
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为___________
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________ 。
②洗涤操作中,选用的最佳洗涤试剂是___________ (填字母)。
A.热水 B.乙醇 C.柠檬酸
II.“速力菲”是市场上一种常见的补铁药物,该药物的主要成分是琥珀酸亚铁,不溶于水,但能溶于人体的胃酸中。某化学兴趣小组用“速力菲”样品进行了如下实验,根据实验流程及现象,回答下列问题:

(3)过程①~⑤中所发生的反应其反应类型不是氧化还原反应的有___________ 。
(4)过程②发生反应的化学方程式为___________ 。
(5)过程④的离子方程式为___________ 。
(6)从实验过程可推知,氧化性:Fe3+___________ (填“> ” “= ”或“<”,下同)I2;还原性:Fe2+___________ Mn2+。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质的性质如下:
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
②洗涤操作中,选用的最佳洗涤试剂是
A.热水 B.乙醇 C.柠檬酸
II.“速力菲”是市场上一种常见的补铁药物,该药物的主要成分是琥珀酸亚铁,不溶于水,但能溶于人体的胃酸中。某化学兴趣小组用“速力菲”样品进行了如下实验,根据实验流程及现象,回答下列问题:

(3)过程①~⑤中所发生的反应其反应类型不是氧化还原反应的有
(4)过程②发生反应的化学方程式为
(5)过程④的离子方程式为
(6)从实验过程可推知,氧化性:Fe3+
实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
实验过程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。
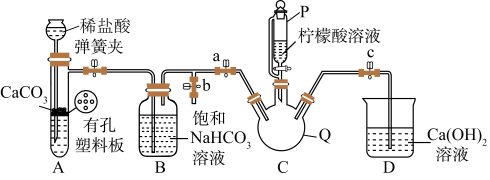
回答下列问题:
(1)仪器P的名称是_______ 。
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______ (填化学式)。
(3)实验Ⅱ中,生成沉淀的离子方程式为_____ 。
(4)实验Ⅲ中,
①检查装置A的气密性的方法是______ 。
②柠檬酸可调节pH,体系pH与产率的关系如下表:
pH过低会使产率下降,其原因是______ ;柠檬酸的作用还有_____ (填字母)。
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_____ (填字母)。
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为_____ 。
| 甘氨酸((NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制备FeCO3:向配制好的FeSO4溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀(过量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排尽,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥后得到产品。

回答下列问题:
(1)仪器P的名称是
(2)实验Ⅰ配制FeSO4溶液时,为防止FeSO4被氧化变质,应加入的试剂为
(3)实验Ⅱ中,生成沉淀的离子方程式为
(4)实验Ⅲ中,
①检查装置A的气密性的方法是
②柠檬酸可调节pH,体系pH与产率的关系如下表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
A.作催化剂
B.作反应终点指示剂
C.促进FeCO3溶解
D.防止二价铁被氧化
③洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是
A.热水 B.稀硫酸
C.乙醇 D.柠檬酸溶液
(5)若产品的质量为16.32g,则产率为
实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1 NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
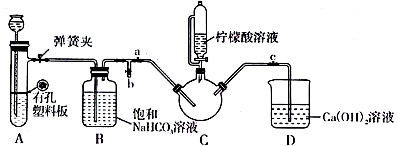
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______ (写化学式)。再滴加少量稀硫酸的作用是__________________________ 。
(2)实验II中:生成沉淀的离子方程式为__________________________ 。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________ 。
②装置A中所盛放的药品是___________________ 。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________ 。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________ 。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________ 。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________ %。
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1 NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为
(2)实验II中:生成沉淀的离子方程式为
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为
②装置A中所盛放的药品是
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


