单选题 较易0.85 引用2 组卷64
关于下列各图的叙述不正确的是
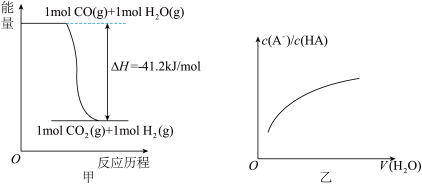
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

| A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.某温度下,pH =11的NH3∙H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3∙H2O与NH3三种微粒的平衡浓度之和为0.05mol∙L-1 |
| C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 |
| D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, |
2020高三·全国·专题练习
类题推荐
关于下列各图的叙述错误的是


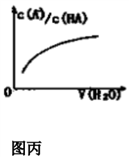



| A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.常温下0.2 mol·L-1 HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-) |
| C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱 |
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,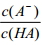 的变化情况 的变化情况 |
CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,
2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1,
CO(g)+H2O(g) ΔH2=+41 kJ·mol-1,
Ⅲ.CO2(g)+H2(g) HCOOH(g) ΔH3<0
HCOOH(g) ΔH3<0
请回答:
(1)仅考虑反应I、Ⅱ,有利于提高CO2平衡转化率的条件是___________。
(2)反应CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的ΔH=
4CO(g)+2H2O(g)的ΔH=___________ kJ·mol-1;
(3)在某恒温、恒容的密闭容器中仅发生反应Ⅲ,CO2和H2的投料浓度均为1.0 mol·L−1,平衡常数K=2.4×10−8,则CO2的平衡转化率为___________ 。
(4)用氨水吸收HCOOH,得到1.00 mol·L−1氨水和0.18 mol·L−1甲酸铵的混合溶液,298 K时该混合溶液的pH=___________ 。 [已知:298 K时,电离常数 Kb(NH3·H2O)=1.8×10−5、 Ka(HCOOH)=1.8×10−4 ]
(5)在3.0MPa,有催化剂的条件下,向密闭容器中充入1molCO2和3molH2,发生反应Ⅱ、Ⅲ,CO2的平衡转化率与HCOOH、CO的选择性随温度的变化如图所示。
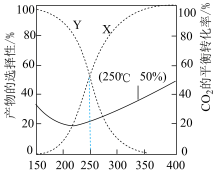
①图中Y曲线代表___________ (填化学式)的选择性。
②CO2的平衡转化率在250℃以后随温度升高而变大的原因:___________ 。
I.CH4(g)+CO2(g)
Ⅱ.CO2(g)+H2(g)
Ⅲ.CO2(g)+H2(g)
请回答:
(1)仅考虑反应I、Ⅱ,有利于提高CO2平衡转化率的条件是___________。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(2)反应CH4(g)+3CO2(g)
(3)在某恒温、恒容的密闭容器中仅发生反应Ⅲ,CO2和H2的投料浓度均为1.0 mol·L−1,平衡常数K=2.4×10−8,则CO2的平衡转化率为
(4)用氨水吸收HCOOH,得到1.00 mol·L−1氨水和0.18 mol·L−1甲酸铵的混合溶液,298 K时该混合溶液的pH=
(5)在3.0MPa,有催化剂的条件下,向密闭容器中充入1molCO2和3molH2,发生反应Ⅱ、Ⅲ,CO2的平衡转化率与HCOOH、CO的选择性随温度的变化如图所示。

①图中Y曲线代表
②CO2的平衡转化率在250℃以后随温度升高而变大的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



