解答题-原理综合题 适中0.65 引用1 组卷74
硫单质和化合物在工农业生产中有着重要的应用,而 直接排放会对环境造成危害。
直接排放会对环境造成危害。
I.已知:重晶石 高温缎烧可发生一系列反应,其中部分反应如下:
高温缎烧可发生一系列反应,其中部分反应如下:




已知:

则:

_____________ ;
 的尾气处理通常有以下几种方法:
的尾气处理通常有以下几种方法:
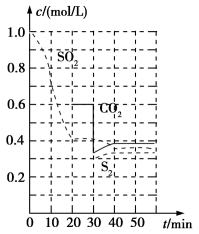
(1)活性炭还原法 反应原理:恒温恒容时 反应进行到不同时间测得各物质的浓度如上图:
反应进行到不同时间测得各物质的浓度如上图:
 反应速率表示为
反应速率表示为
_________________ ;
 时,改变某一条件平衡发生移动,则改变的条件最有可能是
时,改变某一条件平衡发生移动,则改变的条件最有可能是________________________ ;
 时,平衡常数
时,平衡常数
_____________ 。
(2)亚硫酸钠吸收法
 溶液吸收
溶液吸收 的离子方程式为
的离子方程式为____________
 常温下,当吸收至
常温下,当吸收至 时,吸收液中相关离子浓度关系一定正确的是
时,吸收液中相关离子浓度关系一定正确的是_______  填序号
填序号



 水电离出
水电离出
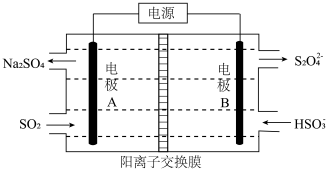
(3)电化学处理法
 如下图所示,
如下图所示, Ⅰ
Ⅰ 电极的反应式为
电极的反应式为___________________ ;
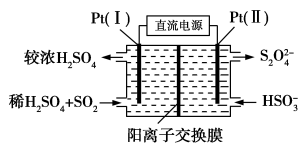
 当电路中转移
当电路中转移 时
时 较浓
较浓 尚未排出
尚未排出 ,交换膜左侧溶液中增加
,交换膜左侧溶液中增加_______ mol离子.
I.已知:重晶石
已知:
则:

(1)活性炭还原法 反应原理:恒温恒容时
(2)亚硫酸钠吸收法
(3)电化学处理法

2020高三·全国·专题练习
类题推荐  、
、 是严重危害环境的气体,多种方法可减少
是严重危害环境的气体,多种方法可减少 、
、 的排放并加以资源利用。
的排放并加以资源利用。
(1) 与CO2发生如下反应:
与CO2发生如下反应: 。相关的化学键键能数据如下表:
。相关的化学键键能数据如下表:
由此计算
___________ 
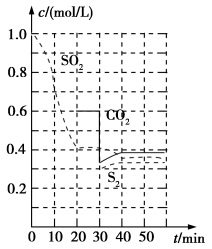
(2)高温下CO可将 还原成硫蒸气,反应体系中各组分的物质的量与反应时间的关系如图所示。写出该反应的化学方程式:
还原成硫蒸气,反应体系中各组分的物质的量与反应时间的关系如图所示。写出该反应的化学方程式:___________ 。
(3)用NaOH吸收 后,所得
后,所得 溶液经电解后可制取
溶液经电解后可制取 溶液,反应装置如图所示。电解时的阴极反应式为
溶液,反应装置如图所示。电解时的阴极反应式为___________ 。
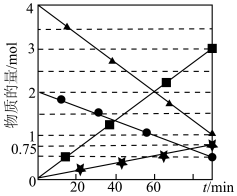
(4)COS水解反应为 。用活性
。用活性 催化,在其他条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入
催化,在其他条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入 和0.1mol COS,COS的平衡转化率如图2所示。
和0.1mol COS,COS的平衡转化率如图2所示。
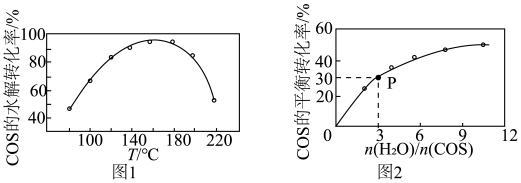
①图1活性 催化水解,随温度升高转化率先增大后又减小的可能原因是
催化水解,随温度升高转化率先增大后又减小的可能原因是___________ 。
②由图2可知,P点时平衡常数为
___________ (填数字)。
(5)某二元酸 在水中的电离方程式是
在水中的电离方程式是 ,
, 。在
。在 的
的 溶液中,下列粒子浓度关系式正确的是
溶液中,下列粒子浓度关系式正确的是___________ (填标号)。
A.
B.
C.
D.
(6)常温下,测得某纯 与水形成的浊液pH为9,已知
与水形成的浊液pH为9,已知 ,
,
 ,忽略
,忽略 的第二步水解,则
的第二步水解,则
___________ 。
(1)
| 化学键 | |||||
| 803 | 742 | 577 | 465 | 339 |
由此计算
(2)高温下CO可将

(3)用NaOH吸收

(4)COS水解反应为

①图1活性
②由图2可知,P点时平衡常数为
(5)某二元酸
A.
B.
C.
D.
(6)常温下,测得某纯
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网