解答题-原理综合题 适中0.65 引用3 组卷595
在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
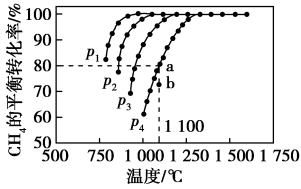
则:(1)该反应的ΔH________ 0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________ 。压强为p4时,在b点:v(正)________ v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________ ;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
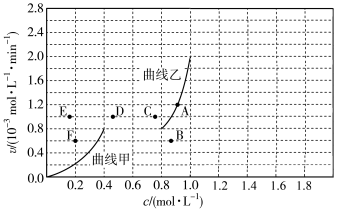
则:①与曲线v正~c(CH4)相对应的是上图中曲线______ (填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________ (填字母)。

则:(1)该反应的ΔH
(2)压强p1、p2、p3、p4由大到小的顺序为
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。

则:①与曲线v正~c(CH4)相对应的是上图中曲线
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为
19-20高三上·四川成都·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO2(g)
2CO2(g) CO2(g)+2H2O(g)
CO2(g)+2H2O(g)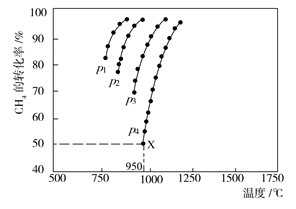
 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L−1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图所示:v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L−1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图所示:v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线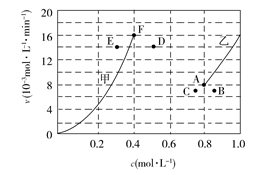 .
.

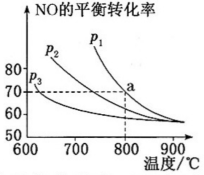
 N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示: