解答题-实验探究题 适中0.65 引用1 组卷137
乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:
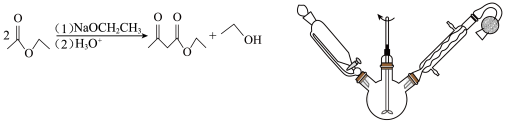
实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______ (填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________ 。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___ 。
(3)分离与提纯操作①中使用的分离仪器是________ 。加入饱和食盐水的作用是 _______ 。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是_______ 。
(5)本实验的产率为_______ %(结果保留两位有效数字)。

| 密度/(g·cm-3) | 沸点/℃ | 水中 溶解性 | |
| 乙酸乙酯 | 0.90 | 77.2 | 难溶 |
| 乙酰乙酸乙酯 | 1.02 | 181 | 微溶 |
| 乙酸 | 1.05 | 118 | 易溶 |
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是
(3)分离与提纯操作①中使用的分离仪器是
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是
(5)本实验的产率为
19-20高二上·江西宜春·期末
类题推荐
乙酰乙酸乙酯是一种无色或微黄色透明液体,是重要的有机合成原料,广泛应用于医药、塑料、染料、香料、清漆及添加剂等行业。实验室常用乙酸乙酯、金属钠、乙酸等试剂
 ,其中乙醇钠(
,其中乙醇钠( )在反应中起到催化剂的作用。
)在反应中起到催化剂的作用。
实验步骤:
Ⅰ.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
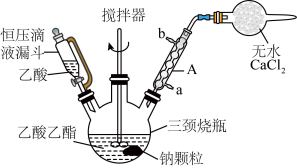
Ⅱ.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL 5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。请回答下列有关问题:
(1)仅器A的优点是_______ ;分离、提纯操作①中使用的分离仪器是_______ 。
(2)本实验中迅速加入切细的金属钠(钠颗粒),也可以采用在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是_______ 。
(3)加入饱和氯化钠溶液的目的为_______ 。
(4)分离、提纯操作③洗涤时的 溶液能否换成NaOH溶液,并简述其理由:
溶液能否换成NaOH溶液,并简述其理由:_______ 。
(5)上述实验中乙酰乙酸乙酯的产率为_______ (保留两位有效数字)。
| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 难溶 |
| 乙酰乙酸乙酯 | 181 | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易溶 |
Ⅰ.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。

Ⅱ.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL 5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。请回答下列有关问题:
(1)仅器A的优点是
(2)本实验中迅速加入切细的金属钠(钠颗粒),也可以采用在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是
(3)加入饱和氯化钠溶液的目的为
(4)分离、提纯操作③洗涤时的
(5)上述实验中乙酰乙酸乙酯的产率为
乙酰乙酸乙酯是一种无色或微黄色透明液体,是重要的有机合成原料,广泛应用于医药、塑料、染料、香料、清漆及添加剂等行业。实验室常用乙酸乙酯、金属钠、乙酸等试剂制备,反应原理: ,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。
,其中乙醇钠(CH3CH2ONa)在反应中起到催化剂的作用。
注:含有烯醇式结构(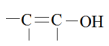 )的有机物遇
)的有机物遇 溶液会变紫色。
溶液会变紫色。
实验步骤:
I.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
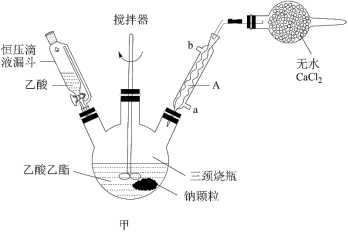
II.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。
请回答下列有关问题:
(1)仪器A的优点是________ ;分离、提纯操作①中使用的分离仪器是________ 。
(2)本实验中迅速加入切细的金属钠(钠颗粒);有的实验是在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是___________ 。
(3)加入饱和氯化钠溶液的目的为___________ 。
(4)分离、提纯操作③洗涤时的 溶液能否换成
溶液能否换成 溶液,并简述其理由:
溶液,并简述其理由:_____ 。
(5)室温下,乙酰乙酸乙酯是一个酮式和烯醇式的混合物所形成的平衡体系(如图乙所示),若用实验方法证明,可选用的化学试剂为___________ (写出一种即可)。

(6)上述实验中乙酰乙酸乙酯的产率为___________ (保留两位有效数字)。
| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 难溶 |
| 乙酰乙酸乙酯 | 181 | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易溶 |
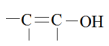 )的有机物遇
)的有机物遇实验步骤:
I.物质制备:向三颈烧瓶中加入10.0mL乙酸乙酯粗品(含乙酸乙酯8.8g和少量乙醇),迅速加入0.1g切细的金属钠(钠颗粒)。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。

II.分离、提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用3mL无水乙酸乙酯萃取两次,分液。
③将①②所得有机层合并,加入5mL5%的碳酸钠溶液洗涤(中和乙酸)至中性,再用无水硫酸镁干燥酯层。先在常压下水浴加热蒸去乙酸乙酯(回收),用水泵将残留的乙酸乙酯抽尽;将剩余液减压蒸溜(若常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯5.1g。
请回答下列有关问题:
(1)仪器A的优点是
(2)本实验中迅速加入切细的金属钠(钠颗粒);有的实验是在圆底烧瓶中将金属钠与二甲苯(沸程138~145℃)共热,待钠熔化后,再用力来回振摇圆底烧瓶,制得细粒状钠珠。这样做的目的是
(3)加入饱和氯化钠溶液的目的为
(4)分离、提纯操作③洗涤时的
(5)室温下,乙酰乙酸乙酯是一个酮式和烯醇式的混合物所形成的平衡体系(如图乙所示),若用实验方法证明,可选用的化学试剂为

(6)上述实验中乙酰乙酸乙酯的产率为
苯乙酮是一种重要的化工原料,制备反应如下:
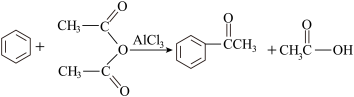 ,CH3COOH+AlCl3→CH3COOAlCl2+HCl↑;
,CH3COOH+AlCl3→CH3COOAlCl2+HCl↑;

实验步骤如下:
步骤1:向如图1所示的仪器A中迅速加入13g粉状无水AlCl3和16mL(0.18mol)无水苯。在搅拌下将4mL(0.04mol)乙酸酐自滴液漏斗慢慢滴加到A中,控制乙酸酐滴加的速度(约10min)。加完后,待反应稍缓和后在沸水浴中搅拌回流。
步骤2:将反应混合物冷却到室温,在搅拌下倒入装有18mL37%的HCl和30g碎冰的烧杯中(在通风橱中进行)使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥,得到粗产品。
步骤3:先将粗产品低温蒸馏回收物质m。稍冷后再减压蒸馏得到产品4.0g。
(1)步骤1中搅拌回流时,冷凝水从_____ (填“a”或“b”)端进水,仪器A的名称_____ 。
(2)步骤1中要逐滴滴加乙酸酐的原因是_____ 。
(3)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是_____ 。用15mL10%NaOH溶液洗涤主要是为了除去_____ (填物质名称)。
(4)步骤3中低温蒸馏回收的物质m为_____ 。
(5)减压蒸馏装置如图2所示,其中毛细管的作用为_____ 。
(6)本次实验苯乙酮的产率为_____ (保留3位有效数字)。
 ,CH3COOH+AlCl3→CH3COOAlCl2+HCl↑;
,CH3COOH+AlCl3→CH3COOAlCl2+HCl↑;
相关物质的部分物理性质 | ||||
| 名称 | 熔点/°C | 沸点/°C | 密度/g·mL-1 | 溶解度 |
| 乙酸酐 | -73 | 140 | 1.082 | 与水反应(生成乙酸) |
| 苯 | 5.5 | 80.5 | 0.879 | 不溶于水 |
| 苯乙酮 | 20.5 | 202 | 1.028 | 微溶于水 |
步骤1:向如图1所示的仪器A中迅速加入13g粉状无水AlCl3和16mL(0.18mol)无水苯。在搅拌下将4mL(0.04mol)乙酸酐自滴液漏斗慢慢滴加到A中,控制乙酸酐滴加的速度(约10min)。加完后,待反应稍缓和后在沸水浴中搅拌回流。
步骤2:将反应混合物冷却到室温,在搅拌下倒入装有18mL37%的HCl和30g碎冰的烧杯中(在通风橱中进行)使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥,得到粗产品。
步骤3:先将粗产品低温蒸馏回收物质m。稍冷后再减压蒸馏得到产品4.0g。
(1)步骤1中搅拌回流时,冷凝水从
(2)步骤1中要逐滴滴加乙酸酐的原因是
(3)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是
(4)步骤3中低温蒸馏回收的物质m为
(5)减压蒸馏装置如图2所示,其中毛细管的作用为
(6)本次实验苯乙酮的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


