解答题-原理综合题 较难0.4 引用4 组卷191
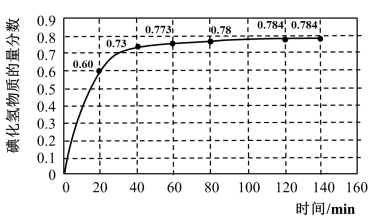
碘及其化合物在人类活动中占有重要地位。已知反应H2(g) + I2(g) 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:

(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率 (HI)=
(HI)=_____ kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率α(H2)=____________ 。
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,
________ (填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是__________ 。
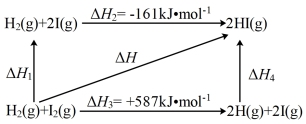
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=________ kJ∙mol-1

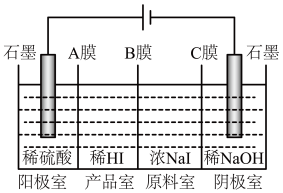
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为______________ 。
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为______ 膜,C膜为______ 膜。

(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率
(2)反应达平衡时,H2的转化率α(H2)=
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,
(4)降低温度,平衡可能逆向移动的原因是
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=


(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为
19-20高三上·福建宁德·期末
类题推荐
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____ kJ·mol-1。
②H—H键能为____ kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:
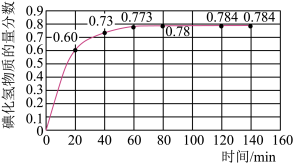
①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率 (I2)=
(I2)=___ kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g) 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时, =
=___ (列出计算式)。
③H2(g)+I2(g) 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___ 。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。
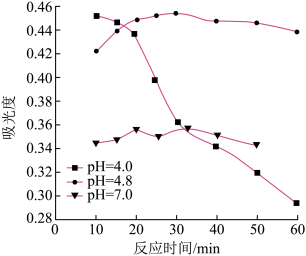
已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___ min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___ 。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___ 。
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
| 化学键 | I—I | H—I |
| 键能/(kJ·mol-1) | 151 | 299 |
①Q=
②H—H键能为
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:

①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率
②在H2(g)+I2(g)
 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,③H2(g)+I2(g)
 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。

已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在
②10min时,不同pH与吸光度的关系是
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是
CH3OCH3是绿色能源,也是化工原料。
(1)已知几种共价键的键能数据如下:
用CO和H2合成CH3OH;CO(g) +2H2(g) CH3OH(g) △H= -99 kJ . mol-1。根据上述信息,表格中E1-E2=
CH3OH(g) △H= -99 kJ . mol-1。根据上述信息,表格中E1-E2=_______ kJ·mol-1。
(2)在恒容密闭容器中充入2 mol CH3OH(g),发生反应2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H,测得CH3OH平衡转化率与温度的关系如图所示。
CH3OCH3(g)+H2O(g) ∆H,测得CH3OH平衡转化率与温度的关系如图所示。
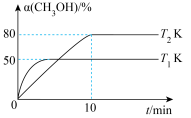
①∆H______ 0(填“>”“<"或“=”),判断依据是__________ 。
②T2K下,平衡常数K=.___________ 。
(3)在T 1K下,CO和CH4混合气体发生反应:CO(g) + CH4(g) CH3CHO(g) ∆H <0,反应速率v=v正-v逆=k正c(CO)· c(CH4) –k逆c( CH3CHO),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
CH3CHO(g) ∆H <0,反应速率v=v正-v逆=k正c(CO)· c(CH4) –k逆c( CH3CHO),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂, 将
将_______ (填“增大”“减小”或“不变”,下同);若升温, 将
将___________ 。
(4)在T2K下,在2L真空容器中充入1 mol CH3OCH3(g),发生反应:CH3OCH3(g) CH4(g) +H2(g) +CO(g)。在不同时间测定容器内的总压数据如下表所示:
CH4(g) +H2(g) +CO(g)。在不同时间测定容器内的总压数据如下表所示:
在该温度下,CH3OCH3的平衡转化率为___________________ 。
(5)科研人员电解酸化的CO2制备CH3OCH3,装置如图所示。

阴极的电极反应式为________ 。
(1)已知几种共价键的键能数据如下:
| 化学键 | H-H | C-O | C | H-O | C-H |
| 436 | E2 | E1 | 465 | 413 |
用CO和H2合成CH3OH;CO(g) +2H2(g)
(2)在恒容密闭容器中充入2 mol CH3OH(g),发生反应2CH3OH(g)

①∆H
②T2K下,平衡常数K=.
(3)在T 1K下,CO和CH4混合气体发生反应:CO(g) + CH4(g)
(4)在T2K下,在2L真空容器中充入1 mol CH3OCH3(g),发生反应:CH3OCH3(g)
| t/min | 0 | 5 | 10 | 15 | 20 | |
| p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
在该温度下,CH3OCH3的平衡转化率为
(5)科研人员电解酸化的CO2制备CH3OCH3,装置如图所示。

阴极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网