解答题-原理综合题 适中0.65 引用1 组卷52
Ⅰ.已知NO(g)+CO2(g)=NO2(g)+CO(g) ΔH1;2CO(g)+O2(g)=2CO2(g) ΔH2
则2NO2(g) 2NO(g)+O2(g)的反应热ΔH=
2NO(g)+O2(g)的反应热ΔH=___ (用含△H1,△H2的代数式表示)。
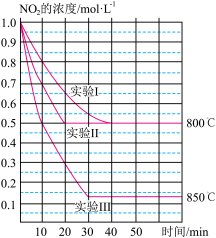
Ⅱ.某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
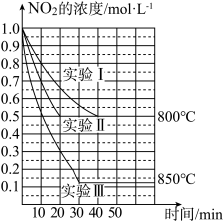
(1)实验Ⅱ隐含的反应条件是___ 。
(2)实验Ⅱ中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为___ 。
(3)800℃时,该反应的平衡常数K=___ 。该反应是___ (填“吸”或“放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时正反应方向速率___ 逆反应方向速率(填“大于”或“等于”或“小于”)。
(5)若实验Ⅰ中达到平衡后,再向密闭容器中再通入一定量的NO2(保持温度不变),一段时间后达到新平衡,则新平衡与原平衡相比混合气体中NO2的体积分数___ (填“增大”或“不变”或“减小”)。
(6)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:
7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:___ 。
则2NO2(g)
Ⅱ.某条件下,在2L密闭容器中发生如下反应:2NO2(g)

(1)实验Ⅱ隐含的反应条件是
(2)实验Ⅱ中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为
(3)800℃时,该反应的平衡常数K=
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时正反应方向速率
(5)若实验Ⅰ中达到平衡后,再向密闭容器中再通入一定量的NO2(保持温度不变),一段时间后达到新平衡,则新平衡与原平衡相比混合气体中NO2的体积分数
(6)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2
19-20高二上·湖北荆门·期末
类题推荐
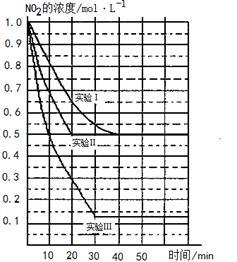
某条件下,在 2L 密闭容器中发生如下反应:2NO2(g)⇌2NO(g)+O2(g)。若反应在三种不同条件下进 行,其中实验 I、Ⅱ都在 800℃,实验 Ⅲ 在 850℃,NO、O2的起始浓度都为 0 mol/L,NO2 的浓度(mol·L-1) 随时间(min)的变化如图所示,请回答下列问题:

(1)对比实验I、Ⅱ和Ⅲ,得出的下列结论中正确的是___________。
(2)若实验I中NO2的起始浓度改为2.0mol·L-1,其它条件不变,则达到平衡时NO2的转化率将___________ (填“增大”、“减小”或“不变”)。
(3)若实验I达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将___________ (填“向左”、“向右”或“不”)移动,达到新平衡时,NO2的物质的量浓度为___________ mol·L-1。
(4)若改变外界条件,使该反应的平衡常数数值变大,下列说法正确的是___________。

(1)对比实验I、Ⅱ和Ⅲ,得出的下列结论中正确的是___________。
| A.实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了 |
| B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂 |
| C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数 |
| D.对比实验I和Ⅲ可知,该反应正反应是吸热反应 |
(3)若实验I达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将
(4)若改变外界条件,使该反应的平衡常数数值变大,下列说法正确的是___________。
| A.一定向正反应方向移动 | B.在平衡移动时,正反应速率先增大后减小 |
| C.一定向逆反应方向移动 | D.在平衡移动时,逆反应速率先增大后减小 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网