解答题-工业流程题 适中0.65 引用4 组卷702
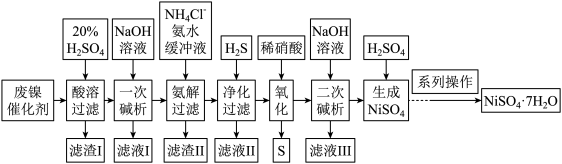
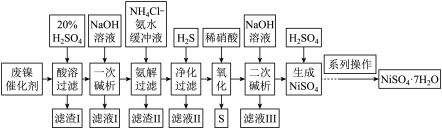
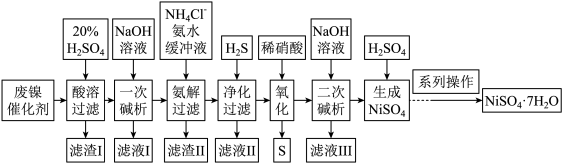
硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________ (任写出一条)。
(2)“滤渣I”的主要成分是_________ 。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________ 。
(4)“氨解”的目的为___ ,“净化”时加入的H2S的目的是将镍元素转化为____ 沉淀。
(5)“氧化”时发生反应的离子方程为________ 。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______ (已知Ni(OH)2的Ksp=2×10-15, ≈1.4)。
≈1.4)。
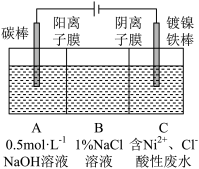
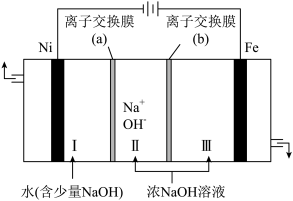
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________ ,离子交换膜(b)为__________ (填“阴”或“阳”)离子交换膜。

已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有
(2)“滤渣I”的主要成分是
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为
(4)“氨解”的目的为
(5)“氧化”时发生反应的离子方程为
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为

2019·云南·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网