解答题-工业流程题 0.4 引用2 组卷402
LiCoO2是锂离子电池最早使用的电极材料,利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如下:
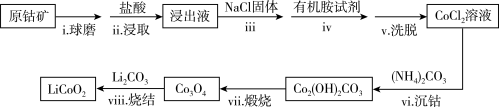
资料:i. 在含一定量Cl−的溶液中,钴离子以CoCl42-形式存在:Co2++4Cl− CoCl42−
CoCl42−
ii. CoCl42−溶于有机胺试剂,有机胺不溶于水。
iii. 盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
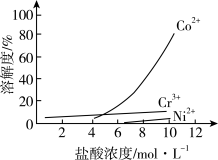
(1)步骤ii选用盐酸的浓度应为__________ 。
a. 4 mol/L b. 6 mol/L c. 10 mol/L
(2)从平衡移动角度解释步骤ⅲ中加入NaCl固体的目的_____________ 。
(3)步骤iv的操作是_______ 。
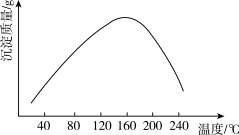
(4)步骤vi用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钴(Co2(OH)2CO3)。实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因____________ 。
(5)步骤viii中Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是_____________ 。
(6)锂离子电池的工作原理如图,充、放电过程中,Li+在LiCoO2电极和碳电极之间传递。电池的总反应为:LixC + Li1-xCoO2 C+LiCoO2
C+LiCoO2
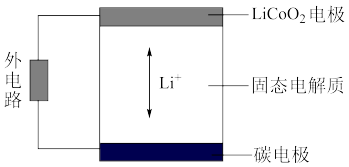
①放电时,电池的负极是______ 。
②充电时,电池的阴极反应式是______ 。

资料:i. 在含一定量Cl−的溶液中,钴离子以CoCl42-形式存在:Co2++4Cl−
ii. CoCl42−溶于有机胺试剂,有机胺不溶于水。
iii. 盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:

(1)步骤ii选用盐酸的浓度应为
a. 4 mol/L b. 6 mol/L c. 10 mol/L
(2)从平衡移动角度解释步骤ⅲ中加入NaCl固体的目的
(3)步骤iv的操作是
(4)步骤vi用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钴(Co2(OH)2CO3)。实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因

(5)步骤viii中Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是
(6)锂离子电池的工作原理如图,充、放电过程中,Li+在LiCoO2电极和碳电极之间传递。电池的总反应为:LixC + Li1-xCoO2

①放电时,电池的负极是
②充电时,电池的阴极反应式是
19-20高三上·北京昌平·期末


