解答题-原理综合题 较难0.4 引用2 组卷325
研究氮氧化物的反应机理,对于消除环境污染有重要意义。
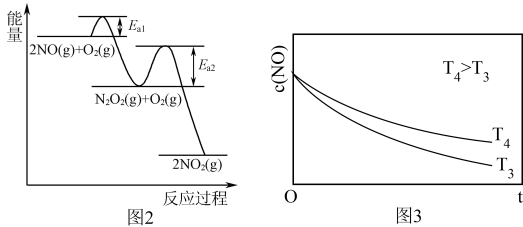
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g) 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g) N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g) 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
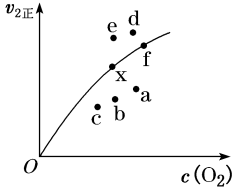
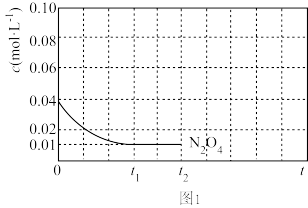
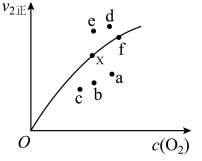
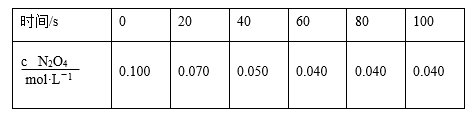
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________ (填字母)。 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________ (填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________ (填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g) 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______ v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=________ kPa·s-1。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)
i:2NO(g)
ii:N2O2(g)+O2(g)
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
②下列能说明该反应达到平衡状态的是
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=
19-20高三上·湖北荆门·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


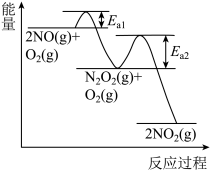
 转化相同量的NO,在温度
转化相同量的NO,在温度