解答题-实验探究题 较难0.4 引用1 组卷56
某学习小组用碳素钢进行了以下探究活动:
[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是______ .
(2)称取6.0g碳素钢放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用______  选填序号
选填序号 .
.
A.KSCN溶液 B.浓氨水 C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560ml(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为______ .
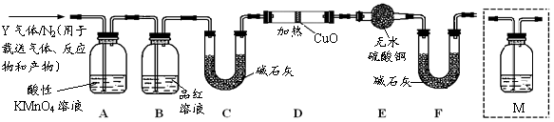
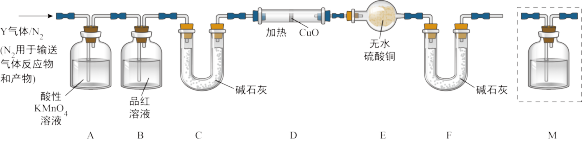
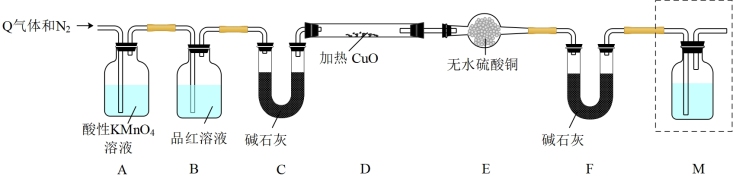
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).
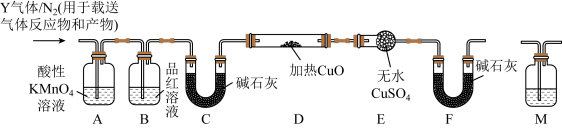
(3)装置B中试剂的作用是______ .
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在______ ,产生Q2的反应的化学方程式为 ______ .
(5)确认含有气体Q3的实验现象是______ ,产生Q3的反应的离子方程式为 ______ .
[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是
(2)称取6.0g碳素钢放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用
A.KSCN溶液 B.浓氨水 C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560ml(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).
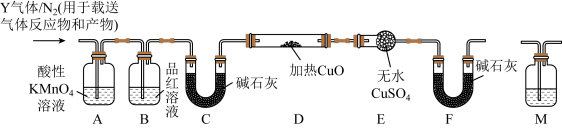
(3)装置B中试剂的作用是
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在
(5)确认含有气体Q3的实验现象是
2020高三·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网