解答题-原理综合题 适中0.65 引用3 组卷511
汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx气体,NOx的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)⇌2NO(g)△H反应温度不平衡常数的关系如下表:
则△H___________________ 0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) ⇌ 2NO2(g)的反应速率不反应物浓度的关系如下表所示
已知反应速率公式为 V 正=K 正×c m(NO)・cn(O2),则 m=___________________ , K 正=___________________ L2・mol-2・s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2气体,发生反应 2NO2(g) ⇌N2O4(g),气体分压随时间的变化关系如图 1 如示。

①该反应的压力平衡常数 KP=___________________ 。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________ kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2在 b 电极上的电极反应式为___________________ 。
(1)通过资料查得 N2(g)+O2(g)⇌2NO(g)△H反应温度不平衡常数的关系如下表:
| 反应温度/℃ | 1538 | 2404 |
| 平衡常数 |
则△H
(2)在 800℃时,测得 2NO(g)+O2(g) ⇌ 2NO2(g)的反应速率不反应物浓度的关系如下表所示
| 初始浓度/ | 初始速率/ | |
| C0(NO) | C0(O2) | |
| 0.01 | 0.01 | |
| 0.01 | 0.02 | |
| 0.03 | 0.02 | |
已知反应速率公式为 V 正=K 正×c m(NO)・cn(O2),则 m=
(3)在某温度下(恒温),向体积可变的容器中充人 NO2气体,发生反应 2NO2(g) ⇌N2O4(g),气体分压随时间的变化关系如图 1 如示。

①该反应的压力平衡常数 KP=
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2在 b 电极上的电极反应式为
2019·河南郑州·一模
类题推荐
氮及其化合物在生产、生活与环境中有着重要研究和应用价值。根据要求回答问题:
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=_______ kJ·mol-1
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)_______ (填“增大”、“不变”或“减小”)
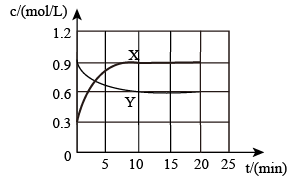
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=_______ mol/(L·s)
③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)= ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=_______ ,保持温度不变,再向密闭容器中充入nmolN2O4,维持总压强为2p0,则在该温度下该反应的压强平衡常数(Kp)=_______ (用各气体物质的分压代替浓度的平衡常数叫压强平衡常数(Kp)。分压=总压×物质的量分数)
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
①pH=9时溶液中c(N )
)_______ c(R+)(填“>”、“=”或“<”),pH=a时溶液中c(HN3)_______ c(N )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)
②HN3的Ka=_______ (精确值)
(4)N2O5是一种新型硝化剂。其制备装置如图所示。
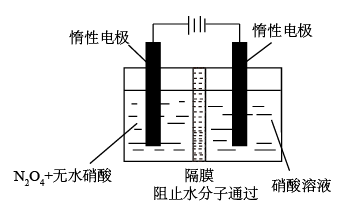
透过隔膜的粒子是_______ ,制取N2O5的电极反应式为_______
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=

③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
| V(HN3)/mL | 0 | 12.50 | 12.75 | 25.00 |
| pH | 13 | 9 | 7 | a |
②HN3的Ka=
(4)N2O5是一种新型硝化剂。其制备装置如图所示。

透过隔膜的粒子是
目前人们对环境保护、新能源开发很重视。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中的氨氧化物NOx,可用CH4催化还原,消除氮氧化物的污染。
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H1=-860.0 kJ·mol-1
②2NO2(g)⇌N2O4(g) △H=-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式:_______ 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)⇌N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该正反应为_______ (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=_______ 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_______ (填“>”“<”或“=”)Kc(B)。
②A、B、C三点中NO2的转化率最低的是_______ (填“A”、“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=_______ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中的氨氧化物NOx,可用CH4催化还原,消除氮氧化物的污染。
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H1=-860.0 kJ·mol-1
②2NO2(g)⇌N2O4(g) △H=-66.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式:
(2)用焦炭还原NO的反应为:2NO(g)+C(s)⇌N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)的容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.60 | 0.60 |
| n(NO)(乙容器,400℃)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器,T℃)/mol | 2.00 | 1.00 | 0.50 | 0.50 | 0.50 |
①该正反应为
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最低的是
③计算C点时该反应的压强平衡常数Kp(C)=
氮及其化合物的利用是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ 。
(2)汽车尾气中的NO和CO在一定条件下可发生反应生成无毒的N2和CO2。将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测得的脱氮率(脱氮率即NO的转化率)如图所示。M点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,理由是_______ 。

(3)通过NOx传感器可监测NOx的含量,其工作原理如图。

①Pt电极上发生的是_______ 反应(填“氧化”或“还原”)。
②写出NiO电极上的电极反应式:_______ 。
(4)某温度下,在一密闭容器中充入一定量NO(g)发生反应4NO(g)⇌N2(g)+2NO2(g) ΔH<0,其正反应速率表达式为v正=k正·cn(NO)(k正为速率常数,只与温度有关),测得反应速率和NO浓度的数据如表所示。
则k正=_______ mol-3·L3·s-1;下列对于该反应的说法正确的是_______ (填标号)。
A.当混合气体颜色保持不变时,反应达到化学平衡状态
B.当 的比值保持不变时,反应达到化学平衡状态
的比值保持不变时,反应达到化学平衡状态
C.反应达到化学平衡状态时,每消耗0.1molNO就会消耗0.05molNO2
D.反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
E.反应达到平衡状态后,若减小压强,则混合气体的平均相对分子质量减小
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
若某反应的平衡常数表达式为K=
(2)汽车尾气中的NO和CO在一定条件下可发生反应生成无毒的N2和CO2。将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测得的脱氮率(脱氮率即NO的转化率)如图所示。M点

(3)通过NOx传感器可监测NOx的含量,其工作原理如图。

①Pt电极上发生的是
②写出NiO电极上的电极反应式:
(4)某温度下,在一密闭容器中充入一定量NO(g)发生反应4NO(g)⇌N2(g)+2NO2(g) ΔH<0,其正反应速率表达式为v正=k正·cn(NO)(k正为速率常数,只与温度有关),测得反应速率和NO浓度的数据如表所示。
| 序号 | c(NO)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.10 | 4.00×10-9 |
| ② | 0.20 | 6.40×10-8 |
| ③ | 0.30 | 3.24×10-7 |
A.当混合气体颜色保持不变时,反应达到化学平衡状态
B.当
C.反应达到化学平衡状态时,每消耗0.1molNO就会消耗0.05molNO2
D.反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
E.反应达到平衡状态后,若减小压强,则混合气体的平均相对分子质量减小
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


