解答题-原理综合题 适中0.65 引用1 组卷93
汽车尾气中CO、氮氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
I.利用甲烷还原NOX
①CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1=-574kJ/mol ;
②CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) △H2=-1160 kJ/mol 。
(1)甲烷直接将NO2还原为N2的热化学方程式为______________________________ 。
(2)在恒容(2L)密闭容器中充入1molCH4和2molNO2进行(1)中反应,CH4的平衡转化率φ。(CH4)与温度和压强的关系如图甲所示。
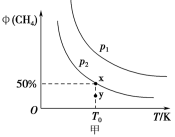
①若容器中的压强为p2,y 点; v 正________ V逆(填“大于"“等于“或“小于”)。
②图中压强大小P1_______ P2
③X 点对应温度下反应的平衡常数K=______________ 。
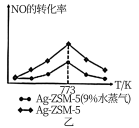
II.某研究小组以Ag-ZSM-5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体。同时利用反应放出的热量预热NO 和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)高于773K,NO的转化率降低的可能原因是_________________ 。
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有_________
I.利用甲烷还原NOX
①CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1=-574kJ/mol ;
②CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) △H2=-1160 kJ/mol 。
(1)甲烷直接将NO2还原为N2的热化学方程式为
(2)在恒容(2L)密闭容器中充入1molCH4和2molNO2进行(1)中反应,CH4的平衡转化率φ。(CH4)与温度和压强的关系如图甲所示。


①若容器中的压强为p2,y 点; v 正
②图中压强大小P1
③X 点对应温度下反应的平衡常数K=
II.某研究小组以Ag-ZSM-5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体。同时利用反应放出的热量预热NO 和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)高于773K,NO的转化率降低的可能原因是
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有
19-20高二上·江西赣州·阶段练习
类题推荐
汽车尾气主要含有CO2 、CO、SO2、NOx 等物质,尾气中CO、氢氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为________________________________ 。
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为_________ (保留两位有效数字,下同)。
②该反应为________ (填“吸热”或“放热”) 反应,实验2条件下的平衡常数K=________ 。
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是_________________________ (用含a、b的数学式表示)。
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为____________ 。
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为_____________ 。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 4 |
| 3 | 900 | a | b | c | d | t |
②该反应为
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义,利用甲烷催化还原NOx消除氮氧化物的污染:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)上述三个反应中ΔH3=___ ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=___ (用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正___ 填“大于”“等于”或“小于”)v逆。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=___ ;
②30min后只改变某一条件,根据上表数据判断改变的条件可能是___ (填序号)。
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
①CH4(g)+4NO2(g)
②CH4(g)+4NO(g)
③CH4(g)+2NO2(g)
(1)上述三个反应中ΔH3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
| 时间/min 浓度/mol⋅L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后只改变某一条件,根据上表数据判断改变的条件可能是
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义,利用甲烷催化还原NOx消除氮氧化物的污染:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3
(1)上述三个反应中ΔH3=___ ,第三个反应的平衡常数表达式为K3=___ 。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
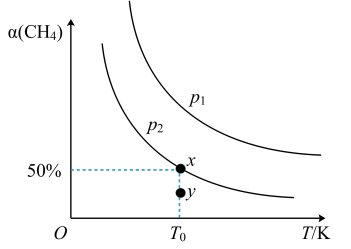
若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)___ v逆。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=___ ;
②30min后只改变某一条件,根据上表数据判断改变的条件可能是__ (填序号)。
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
①CH4(g)+4NO2(g)
②CH4(g)+4NO(g)
③CH4(g)+2NO2(g)
(1)上述三个反应中ΔH3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
| 时间 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后只改变某一条件,根据上表数据判断改变的条件可能是
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


