填空题 较易0.85 引用1 组卷138
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是___________ (用离子方程式表示).
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO‾)=c(Na+),则CH3COOH 溶液的体积_____ NaOH 溶液的体积.(填“大于”、“小于”或“等于”.)
(3)常温下,取0.2mol•L﹣1 HCl溶液与0.2mol•L﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式:_______________________ .
(4)含 的废水毒性较大,某工厂废水中含5.0×10﹣3 mol•L﹣1的
的废水毒性较大,某工厂废水中含5.0×10﹣3 mol•L﹣1的 .为了使废水的排放达标,进行如下处理:
.为了使废水的排放达标,进行如下处理:
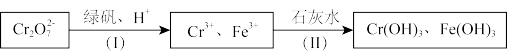
①绿矾为FeSO4•7H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为_____ .
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 mol•L﹣1,则处理后的废水的pH=_____ (Ksp[Cr(OH)3]=6.0×10﹣31)
(1)生活中明矾常作净水剂,其净水的原理是
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO‾)=c(Na+),则CH3COOH 溶液的体积
(3)常温下,取0.2mol•L﹣1 HCl溶液与0.2mol•L﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式:
(4)含
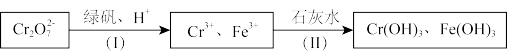
①绿矾为FeSO4•7H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 mol•L﹣1,则处理后的废水的pH=
19-20高二上·河北衡水·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网