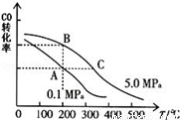
解答题-原理综合题 较难0.4 引用3 组卷272
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________ 。
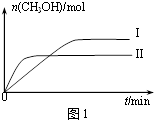
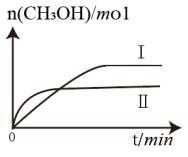
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________ 。
③一定温度下,此反应在恒压 容器中进行,能判断该反应达到化学平衡状态的依据是______________ 。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
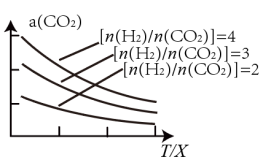
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________ ;该反应△H_________ 0(填“>”、“<”或“=”)。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)

②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
③一定温度下,此反应在
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)

18-19高三上·黑龙江哈尔滨·期中
类题推荐
I.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。
已知:a.Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
b.C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为___________________ 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。

①曲线对应的平衡常数大小关系为KI_____ (填“>”“=”或“<”)KII。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为___________ 。
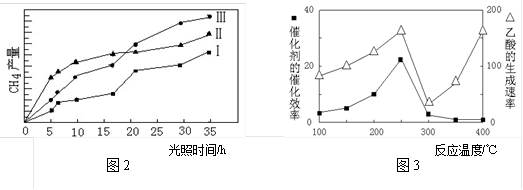
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图所示。在0~15h内,CH4的平均生成速率I、II和III从大到小的顺序为_____________ 。

II.固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图所示。

(1)b为电源的_________ (填“正极”或“负极”);
(2)写出电极c发生的电极反应式:______ 、______ 。
(1)CO可用于炼铁。
已知:a.Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
b.C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)

①曲线对应的平衡常数大小关系为KI
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图所示。在0~15h内,CH4的平均生成速率I、II和III从大到小的顺序为

II.固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图所示。

(1)b为电源的
(2)写出电极c发生的电极反应式:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(g)
CH3OH(g)