解答题-结构与性质 适中0.65 引用3 组卷346
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______ 。
(2)Na、O、S简单离子半径由大到小的顺序为___________ (用简单离子符号表示离子半径)。
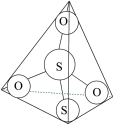
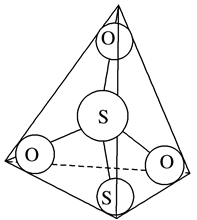
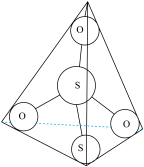
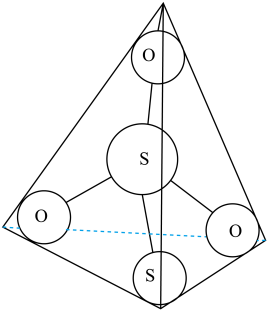
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________ 。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________ 。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________ ;与SO3相比,____________ 的键角更大,原因是________________________________ 。
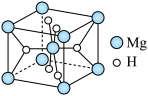
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________ ,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为
(2)Na、O、S简单离子半径由大到小的顺序为

(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为
(4)Na3[Ag(S2O3)2]中存在的作用力有
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为

(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为
19-20高三上·湖北荆门·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网