解答题-原理综合题 较难0.4 引用1 组卷126
Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____ kJ。

Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s) 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。

(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
①该反应的△H_____ 0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________ 。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________ 。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。
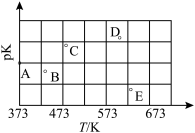
① A点的数值为_________ (已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______ 点。
Ⅲ. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
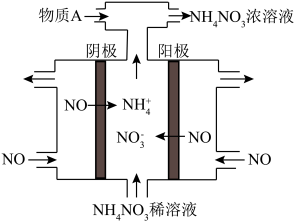
①阴极的电极反应式为_________________________ 。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________ 。

Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)
 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
| Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
②反应开始至达到平衡时,v(SCl2)=
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
Ⅲ. (4) 电解NO2制备NH4NO3,其工作原理如图所示。

①阴极的电极反应式为
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为
18-19高三下·广西南宁·阶段练习
类题推荐
二氧化硫、氯气、氧化亚砜均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)
2SOCl2(g)
(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据Ⅰ(反应达到平衡时的温度与起始温度相同,P0为初始压强)。
谪回答下列问题:
①该反应的△H_________ (填“>”“ <”或“=”)0。
②若只改变某一条件,其他条件相同时.测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_________ 。
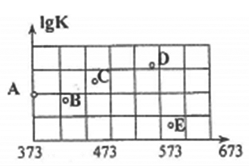
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
①A点的数值为______________ 。(已知:lg4=0.6)
②当升高到某一温度时.反应重新达到平衡,A点可能变化为___________ 点。
(3)已知反应 S4(g)+4Cl2(g) = 4SCl2(g)的△H=-4kJ·mol-1,1molS4(g)、lmolSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________ kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2Ka2=1.02×10-7。
①SOCl2溶于水中可形成两种酸,其中HCl的物质的量浓度为10mol/L时,H2SO3的物质的量浓
度_______ (大于、小于、等于)1.25mol/L。
②向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=amL时,溶液中离子浓度有如下关系:c (Na+) =2c (SO32-) +c (HSO3-) ;当V=bmL时,溶液中离子浓度有如下关系:c (Na+) =c(SO32-) +c (HSO3-) +c(H2SO3);则 a________ b(大于、小于、等于)。
 2SOCl2(g)
2SOCl2(g)(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据Ⅰ(反应达到平衡时的温度与起始温度相同,P0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| Ⅰ | P | 6.0 P0 | 6.7 P0 | 6.l P0 | 5.4 P0 | 5.0 P0 | 5.0 P0 |
| II | P | 6.0 P0 | 7.0 P0 | 5.3 P0 | 5.O P0 | 5.0 P0 | 5.0 P0 |
谪回答下列问题:
①该反应的△H
②若只改变某一条件,其他条件相同时.测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
①A点的数值为
②当升高到某一温度时.反应重新达到平衡,A点可能变化为
(3)已知反应 S4(g)+4Cl2(g) = 4SCl2(g)的△H=-4kJ·mol-1,1molS4(g)、lmolSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2Ka2=1.02×10-7。
①SOCl2溶于水中可形成两种酸,其中HCl的物质的量浓度为10mol/L时,H2SO3的物质的量浓
度
②向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=amL时,溶液中离子浓度有如下关系:c (Na+) =2c (SO32-) +c (HSO3-) ;当V=bmL时,溶液中离子浓度有如下关系:c (Na+) =c(SO32-) +c (HSO3-) +c(H2SO3);则 a
二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g)。该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。

(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
请回答下列问题:
①该反应的ΔH___ (填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)=___ 。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是___ 。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为____ 。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为___ 点。
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为___ kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3),则c(H+)
)>c(H2SO3),则c(H+)___ c(OH-)(填“大于”、“小于”或“等于”,下同)
②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO )+c(HSO
)+c(HSO );当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO
);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO3);则a
)+c(H2SO3);则a___ b。
(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式___ 。

(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| Ⅰ | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| Ⅱ | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
①该反应的ΔH
②I反应开始至达到平衡时,v(SOCl2)=
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
(3)已知反应S4(g)+4Cl2(g)=4SCl2(g)的ΔH=-4kJ•mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2,Ka2=1.02×10-7,向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO
②当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO
(5)以SOCl2溶解四氯铝锂的溶液作为电解质溶液,用金属锂和石墨作电极材料,可组成一种常见的锂电池,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,请写出该电池正极的电极反应方程式
二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) ⇌ 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
请回答下列问题:
①该反应的ΔH______________ (填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)=______________ 。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________ 。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为______________ 。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________ 点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________ kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________ c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a_________ b。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH
②I反应开始至达到平衡时,v(SOCl2)=
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


