解答题-原理综合题 较难0.4 引用1 组卷203
乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+ O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
①由此计算x=___ ,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___ 。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___ P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+ O2(g)=C2H4(g)+H2O(l) ΔH3=
O2(g)=C2H4(g)+H2O(l) ΔH3=___ 。
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___ 。
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____ 。
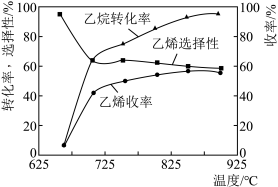
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___ ;反应的最佳温度为___ (填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃

[乙烯选择性= ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中 的最佳值是
的最佳值是___ ;判断的理由是___ 。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___ 。
(6)反应达平衡时,各组分的体积分数如下表:
计算该温度下的平衡常数Kp=___ (用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
| 化学键 | H-H(g) | H-O(g) | O=O(g) |
| 键能(kJ·mol-1) | 436 | X | 496 |
①由此计算x=
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1
③请求出下列反应的反应热:C2H6(g)+
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:

(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是
A.700℃ B.750℃ C.850℃ D.900℃

[乙烯选择性=
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是
(6)反应达平衡时,各组分的体积分数如下表:
| C2H6 | O2 | C2H4 | H2O | 其他物质 |
| 2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=
19-20高二上·浙江·期中
类题推荐
乙烯是一种重要的基本化工原料,传统方法由丁烷裂解制备,现代工艺中利用乙烷的氧化裂解获得。两种工业方法的原理如下:
I.CH3CH2CH2CH3(g) CH2=CH2(g)+CH3CH3(g) △H1
CH2=CH2(g)+CH3CH3(g) △H1
II.C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) △H2=-110 kJ/mol
C2H4(g)+H2O(g) △H2=-110 kJ/mol
(1)化学上,将稳定单质的能量定为0,由元素的单质化合生成1 mol单一化合物的反应热叫该化合物的生成热,生成热可表示该物质的相对能量。25℃、101 kPa下几种有机物的生成热如下表所示(a、b、c均大于零) :
由正丁烷裂解生成乙烯的△H1=______ kJ/mol (用含a、b、c的式子表示)。
(2)在一定温度下,向恒压密闭容器中充入一定量正丁烷,反应生成乙烯和乙烷,经过一段时间达到平衡状态,则下列情况下不能说明该反应达到平衡状态的是______ (填标号)。
A.反应热△H保持不变 B. 保持不变
保持不变
C.气体密度保持不变 D.正丁烷生成速率与乙烯消耗速率相等
(3)乙烷的氧化裂解反应物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),如图为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是_______ ,反应的最佳温度为________ (填序号)。

A.700℃ B.750℃ C.850℃ D.900℃
[乙烯的选择性= ,乙烯收率=乙烷转化率×乙烯选择性]
,乙烯收率=乙烷转化率×乙烯选择性]
(4)工业上,保持体系总压恒定为100 kP的条件下进行反应II,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是_________________ 。反应达平衡时,各组分的体积分数如表:
计算该温度下的平衡常数Kp=_______ 。
(5)乙烯—空气燃料电池以熔融的K2CO3为电解质时,该燃料电池的正极反应式为2CO2+O2+4e-=2 , 则负极反应式为
, 则负极反应式为______ 。
I.CH3CH2CH2CH3(g)
II.C2H6(g)+
(1)化学上,将稳定单质的能量定为0,由元素的单质化合生成1 mol单一化合物的反应热叫该化合物的生成热,生成热可表示该物质的相对能量。25℃、101 kPa下几种有机物的生成热如下表所示(a、b、c均大于零) :
物质 | 乙烷 | 乙烯 | 正丁烷 |
生成热/ (kJ/mol ) | -a | b | -c |
由正丁烷裂解生成乙烯的△H1=
(2)在一定温度下,向恒压密闭容器中充入一定量正丁烷,反应生成乙烯和乙烷,经过一段时间达到平衡状态,则下列情况下不能说明该反应达到平衡状态的是
A.反应热△H保持不变 B.
C.气体密度保持不变 D.正丁烷生成速率与乙烯消耗速率相等
(3)乙烷的氧化裂解反应物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),如图为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是

A.700℃ B.750℃ C.850℃ D.900℃
[乙烯的选择性=
(4)工业上,保持体系总压恒定为100 kP的条件下进行反应II,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=
(5)乙烯—空气燃料电池以熔融的K2CO3为电解质时,该燃料电池的正极反应式为2CO2+O2+4e-=2
低碳烯烃(乙烯、丙烯、丁烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
I.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原NO。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol
(1)反应

______ kJ⋅mol 。
。
Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯。相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):
表1
(2)已知C2H4选择性:转化的乙烷中生成乙烯的百分比。反应温度为650℃时,较优的催化剂为______ (填“钴盐”或“铬盐”)。对比实验②③④可得出结论:____________ (从温度对C2H6的转化率和C2H4的选择性的影响角度分析)。
Ⅲ.一定条件下,碘甲烷(CH3I)热裂解制低碳烯烃的主要反应有:
反应i:


反应ii:


反应iii:


反应i、ii、iii在不同温度下的分压平衡常数 如表2,回答下列问题:
如表2,回答下列问题:
表2
(3)根据表中数据推出反应ⅰ的活化能 (正)
(正)______ (填“>”或“<”) (逆)。
(逆)。
(4)实际工业生产中,若存在副反应:

 ,结合表2数据分析
,结合表2数据分析
______ (填“>”或“<”)0,陈述理由:_____________ 。
(5)其他条件不变,起始压强为0.1a MPa,向容积为1 L的恒容密闭容器中投入1 mol ,只发生反应i、ii、iii,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图。
,只发生反应i、ii、iii,反应温度对平衡体系中乙烯、丙烯和丁烯所占气体组分物质的量分数的影响如图。
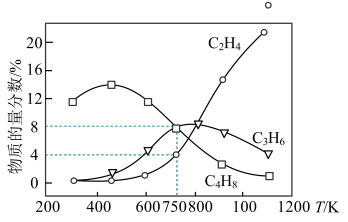
一定能说明该体系达到平衡状态的是____________ (填标号)。715 K条件下,平衡时,体系中
_______ ,反应ⅰ的压强平衡常数 =
=_______ (列出计算式)MPa。
A.CH3I的转化率达到最大值 B.
C.气体的密度不再发生变化 D.各气体组分的百分含量保持不变
I.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原NO。
已知:
(1)反应
Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯。相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):
表1
| 实验编号 | ① | ② | ③ | ④ |
| 反应温度/℃ | 650 | 650 | 600 | 550 |
| 催化剂 | 钴盐 | 铬盐 | ||
| C2H6的转化率/% | 19.0 | 32.1 | 21.2 | 12.0 |
| C2H4的选择性/% | 17.6 | 77.3 | 79.7 | 85.2 |
Ⅲ.一定条件下,碘甲烷(CH3I)热裂解制低碳烯烃的主要反应有:
反应i:
反应ii:
反应iii:
反应i、ii、iii在不同温度下的分压平衡常数
表2
| 298K | 323K | 423K | 523K | 623K | 723K | |
| 反应i | 2.80 | |||||
| 反应ii | ||||||
| 反应iii | 2.24 |
(4)实际工业生产中,若存在副反应:
(5)其他条件不变,起始压强为0.1a MPa,向容积为1 L的恒容密闭容器中投入1 mol

一定能说明该体系达到平衡状态的是
A.CH3I的转化率达到最大值 B.
C.气体的密度不再发生变化 D.各气体组分的百分含量保持不变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2
2 (g) △H1=-206.6kJ•mol-1
(g) △H1=-206.6kJ•mol-1 (g)+5O2(g)=4CO2(g)+4H2O(1)
(g)+5O2(g)=4CO2(g)+4H2O(1) (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2( ),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正•c2(CH2=CH2)•c(O2)(k正、k逆为速率常数,只与温度有关)。