计算题 较难0.4 引用1 组卷303
电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________ 。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____ 。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____ ,溶液中c(CH3COO-)/c(CH3COOH) =___________ 。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)⇌CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________ 。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______ 。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)⇌CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于
19-20高二上·安徽六安·阶段练习
类题推荐
电解质水溶液中存在电离平衡、水解平衡、沉淀溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-) _______ c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②将少量CO2通入NaCN溶液,反应的离子方程式是_______ 。
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中 =
=_______ 。
(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为_______ 。
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol/L。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.75×10-6 | Ka=6.2×10-10 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
②将少量CO2通入NaCN溶液,反应的离子方程式是
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是
(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1 mol/L NaHCO3溶液中,c(CN-)______ c( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
②将少量CO2通入NaCN溶液,反应的离子方程式是_____ 。
③室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____ 。
④室温下,某溶液中存在着CH3COOH(aq)+ (aq)
(aq) CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=
CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=___________ 。
(2)常温下,将a mol·L-1的醋酸与 b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=________________ (用含a和b的代数式表示)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1 mol/L NaCN溶液和0.1 mol/L NaHCO3溶液中,c(CN-)
②将少量CO2通入NaCN溶液,反应的离子方程式是
③室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
④室温下,某溶液中存在着CH3COOH(aq)+
(2)常温下,将a mol·L-1的醋酸与 b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______ c(HCO3 -)(填“>”、“<”或“=”)。②常温下,pH相同的三种溶液A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________ (填编号)。
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为________________________________________ 。
④将少量CO2通入NaCN溶液,反应的离子方程式是______________________________ 。
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是________________ ,溶液中c(CH3COO—)/c(CH3COOH)___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
①d点所示的溶液中离子浓度由大到小的顺序依次为_______________ 。
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=__________ (用溶液中的其它离子浓度表示)。
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为____ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
③已知25℃时,CH3COOH(aq)+OH -( aq)=CH3COO-(aq) +H2O(1) △H=-akJ/mol,H+(aq) +OH-(aq) =H2O(1) △H=-b kJ/mol,醋酸电离的热化学方程式为
④将少量CO2通入NaCN溶液,反应的离子方程式是
⑤室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
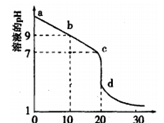
①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


