解答题-工业流程题 适中0.65 引用1 组卷75
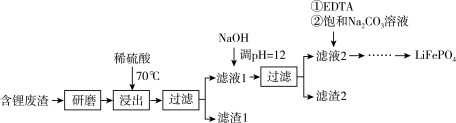
用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)
ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
ⅲ某些物质溶解度(S):
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是___ 。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是______ 。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是____ g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
II.纯化Li2CO3粗品
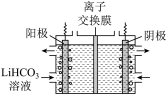
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是_______ 。
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__ 。

资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)
| Li+ | Ni2+ | Ca2+ | Mg2+ | |
| 滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
| 滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ⅲ某些物质溶解度(S):
| T/℃ | 20 | 40 | 60 | 80 | 100 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
| S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
(l)上述流程中为加快化学反应速率而采取的措施是
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是

III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是
19-20高二上·江西上饶·阶段练习
类题推荐
用含锂废渣(主要金属元素的含量:Li 3.50%、Ni 6.55%、Ca 6.41%、Mg 13.24%)制备Li2CO3,并用其制备锂离子电池的正极材料LiFePO4。部分工艺流程如下:

资料:i.滤液1、滤液2中部分离子的浓度(g‧L-1):
ii.EDTA能和某些二价金属离子形成的水溶性络合物。
iii.某些物质的溶解度(S):
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是__________ 。
(2)滤渣2的主要成分有___________ 。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出固体Li2CO3粗品的操作是_________ 。
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,该池使用了___________ (填“阳”或“阴”)离子交换膜。

III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________________ 。
IV.(6)FePO4是一种难溶于水的易溶于硫酸的白色固体,FePO4在pH=2时沉淀效果最好,邻二氮菲与Fe2+结合生成稳定的橙红色邻二氮菲亚铁离子,与Fe3+形成浅蓝色邻二氮菲铁离子。实验室可以利用FeSO4•7H2O和H3PO4(弱酸)制备FePO4。其制备的步骤为取一定量的FeSO4•7H2O溶解于稍过量的H3PO4中,(请补充完操作步骤)_________ 。(可以使用的试剂有邻二氮菲试剂、20%H2O2溶液、NaOH溶液、蒸馏水。)

资料:i.滤液1、滤液2中部分离子的浓度(g‧L-1):
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
iii.某些物质的溶解度(S):
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
(l)上述流程中为加快化学反应速率而采取的措施是
(2)滤渣2的主要成分有
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出固体Li2CO3粗品的操作是
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,该池使用了

III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是
IV.(6)FePO4是一种难溶于水的易溶于硫酸的白色固体,FePO4在pH=2时沉淀效果最好,邻二氮菲与Fe2+结合生成稳定的橙红色邻二氮菲亚铁离子,与Fe3+形成浅蓝色邻二氮菲铁离子。实验室可以利用FeSO4•7H2O和H3PO4(弱酸)制备FePO4。其制备的步骤为取一定量的FeSO4•7H2O溶解于稍过量的H3PO4中,(请补充完操作步骤)
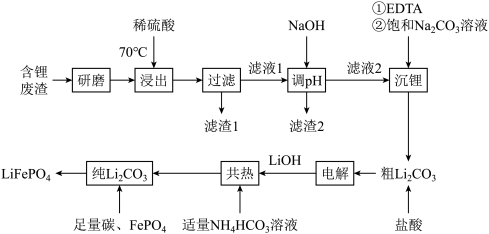
磷酸亚铁锂电池是新能源汽车的动力电池之一、用含锂废渣(主要金属元素有Li、Ni、Ca,Mg)制得 ,纯化后用其制备电池的正极材料
,纯化后用其制备电池的正极材料 ,工艺流程如下:
,工艺流程如下:
已知:①EDTA能与某些二价金属离子形成稳定的水溶性配合物。
②滤液1、滤液2中部分离子的浓度( )见下表。
)见下表。
③某些物质的溶解度(S)见下表。
回答下列问题:
(1)为加快“浸出”速率,本工艺中采取的措施有___________ 。
(2)滤渣2的主要成分有___________ 和 (填化学式)。
(填化学式)。
(3)“沉锂”中,先加入EDTA,其作用是___________ ;再加入饱和 溶液,控制温度在95℃充分反应后,分离出粗
溶液,控制温度在95℃充分反应后,分离出粗 的操作是
的操作是___________ 。
(4)生成纯 的离子方程式为
的离子方程式为___________ 。
(5)纯 和足量碳、
和足量碳、 高温下反应,生成
高温下反应,生成 和一种可燃性气体,该反应的化学方程式为
和一种可燃性气体,该反应的化学方程式为___________ 。

已知:①EDTA能与某些二价金属离子形成稳定的水溶性配合物。
②滤液1、滤液2中部分离子的浓度(
| 滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
| 滤液2 | 21.94 | 0.08 |
| T/℃ | 20 | 40 | 60 | 80 | 100 |
| 1.33 | 1.17 | 1.01 | 0.85 | 0.72 | |
| 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
(1)为加快“浸出”速率,本工艺中采取的措施有
(2)滤渣2的主要成分有
(3)“沉锂”中,先加入EDTA,其作用是
(4)生成纯
(5)纯
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:

已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________ 。

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________ 。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________ 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________ 。
②电解后,LiOH溶液浓度增大的原因_____ ,b中,生成Li2CO3反应的化学方程式是_______ 。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:
LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________ 。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为_____ 。

已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)
②某些物质的溶解度(S)如下表所示。
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)
(3)最后一个步骤中,用“热水洗涤”的目的是
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是
②电解后,LiOH溶液浓度增大的原因
(5)磷酸亚铁锂电池总反应为:FePO4+Li
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


