解答题-原理综合题 适中0.65 引用1 组卷30
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=___ 。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__ 。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
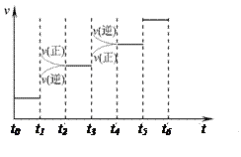
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是___ 。
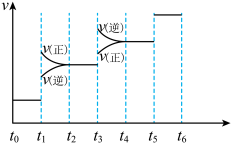
其中表示平衡混合物中NH3的含量最高的一段时间是___ 。
(4)温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的化学平衡常数的为___ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=
(2)工业合成氨气的反应为N2(g)+3H2(g)
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是

其中表示平衡混合物中NH3的含量最高的一段时间是
(4)温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的化学平衡常数的为
19-20高二上·江西南昌·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 2NH3(g)∆H=-92.4kJ·mol-1。请回答:
2NH3(g)∆H=-92.4kJ·mol-1。请回答: