解答题-实验探究题 适中0.65 引用1 组卷140
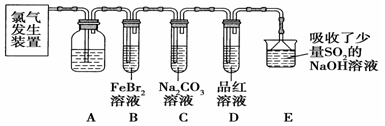
某同学为了验证Fe3+是否能将H2SO3氧化成SO42-,用50 mL 0.1 mol·L-1 FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42-操作为_____________________________________________ ,证明Fe3+能够把H2SO3氧化成SO42-。
(2)请配平并完成上述反应中的化学方程式:2FeCl3+SO2+________ =________ +H2SO4+________ ,反应中的氧化产物是________ (写化学式)。
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe2+;
假设2:溶液中存在Fe3+、Fe2+;
假设3:溶液中存在_____________________________________________________ 。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1 mol·L-1 KMnO4溶液、0.1 mol·L-1 KSCN溶液、品红稀溶液。
(1)检验吸收液中的SO42-操作为
(2)请配平并完成上述反应中的化学方程式:2FeCl3+SO2+
(3)吸收液中除了含有H+、Cl-、SO42-以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe2+;
假设2:溶液中存在Fe3+、Fe2+;
假设3:溶液中存在
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1 mol·L-1 KMnO4溶液、0.1 mol·L-1 KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3 mL,并滴入 | 若出现红色,则假设2成立,1、3不成立;若未出现红色,则假设2不成立,假设1或3成立 |
| 步骤2: | |
| 步骤3: |
2019高三·全国·专题练习
类题推荐
实验题组
Ⅰ.下图所示的实验,能达到实验目的的是 。
Ⅱ.某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式: ;
(2)检验吸收液中SO42–的方法: ;
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
Ⅰ.下图所示的实验,能达到实验目的的是 。
| A | B | C | D |
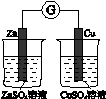 |  |  |  |
| 验证化学能 转化为电能 | 验证温度对化学平衡的影响 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式: ;
(2)检验吸收液中SO42–的方法: ;
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | (1) 若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立。 |
步骤2: | |
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式:_____________________________________ 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1-、SO42-。某同
学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
(3)测定空气中SO2含量的方法是:把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI 溶液25.00mL,则空气中的SO2含量为_________ mg/L。(5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,10I-+2MnO4-+16H+=2Mn2++5I2+8H2O)
(1)写出SO2与FeC13溶液反应的离子方程式:
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1-、SO42-。某同
学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网