解答题-工业流程题 较易0.85 引用1 组卷133
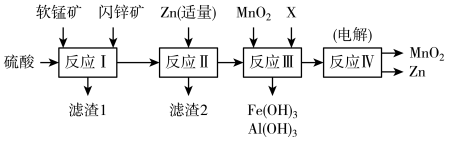
某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
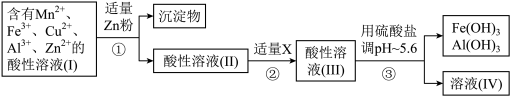
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.
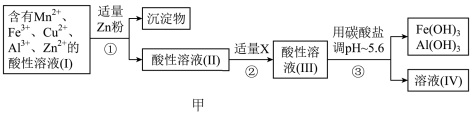
a、操作①中加Zn粉后发生反应的离子方程式为______ .
b、操作②中加入适量X的作用是什么______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是______ .
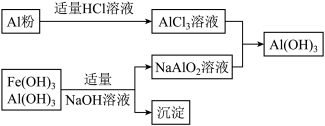
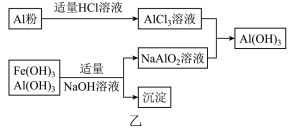
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
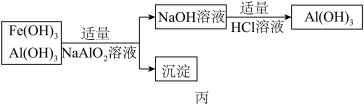
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______ .
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.



a、操作①中加Zn粉后发生反应的离子方程式为
b、操作②中加入适量X的作用是什么
c、操作③中所加碳酸盐的化学式是
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?
2019高三·福建·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网