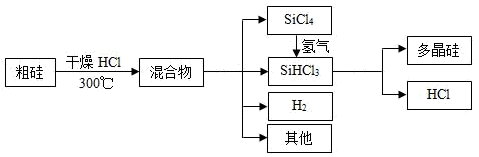
填空题 适中0.65 引用1 组卷42
多晶硅是制作光伏电池的关键材料。将SiCl4氢化为SiHCl3的热化学方程式为:3SiCl4+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
(1)该反应是____________ 反应(填吸热、放热)
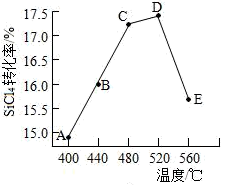
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是________________ (填序号)。
a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:___ 。(只写出一条)
(1)该反应是
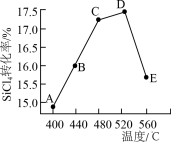
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是

a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:
19-20高二上·河北张家口·阶段练习
类题推荐
Ⅰ.“十四五”规划明确了“碳达峰、碳中和”工作的定位。某科研机构想利用CO2和H2合成燃料。已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2
③C(s)+2H2(g) CH4(g) ΔH3
CH4(g) ΔH3
④2CO(g) C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4
(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为_______ 。
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:
(2)H2的平衡转化率=_______ 。该条件下上述反应的平衡常数K=_______ 。
(3)下列措施中能使平衡体系中 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。
(4)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1_______ c2(填“>”、“<”或“=”)。
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
(6)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。
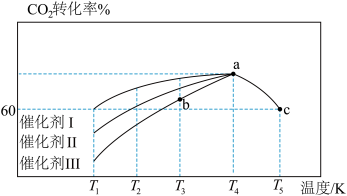
则催化效果最佳的是催化剂_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。如果a点已经达到平衡状态,则b点的v正_______ v逆(填“>”、“<”或“=”),c点转化率比a点低的原因是_______ 。
①CO2(g)+3H2(g)
②CO(g)+H2O(g)
③C(s)+2H2(g)
④2CO(g)
(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g)
| 时间/min | 0 | 3 | 5 | 10 | 15 |
| 浓度/mol/L | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(3)下列措施中能使平衡体系中
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
| A.加入催化剂 | B.增大CO2的浓度 | C.通入惰性气体 | D.通入H2 |

则催化效果最佳的是催化剂
I.CO2可用来生产燃料甲醇。CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=- 49kJ·mol-1。在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:
(1)H2的平衡转化率=_______ 。该条件下上述反应的平衡常数K=_______ 。
(2)下列措施中能使平衡体系中 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。
(3)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1_______ c2(填“>”、“<”或“=”)。
(4)要提高CO2的转化率,可以采取的措施是_______ (填序号)。
A.加入催化剂 B.增大CO2的浓度 C.通入惰性气体 D.通入H2 E.分离出甲醇
(5)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。
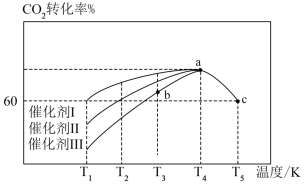
则催化效果最佳的是催化剂_______ (填“I”、“II”或“III”)。如果a点已经达到平衡状态,则b点的v正_______ v逆(填“>”、“<”或“=”),c点转化率比a点低的原因是_______ 。
| 时间/ | 0 | 3 | 5 | 10 | 15 |
| 浓度/mol/L | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(1)H2的平衡转化率=
(2)下列措施中能使平衡体系中
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(4)要提高CO2的转化率,可以采取的措施是
A.加入催化剂 B.增大CO2的浓度 C.通入惰性气体 D.通入H2 E.分离出甲醇
(5)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。

则催化效果最佳的是催化剂
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网