填空题 适中0.65 引用6 组卷341
“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K= ,则此反应的热化学方程式为
,则此反应的热化学方程式为____________________ 。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g) 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________ 。2~5 min内用NO2表示的该反应的平均反应速率为________________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________ (填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________ (用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
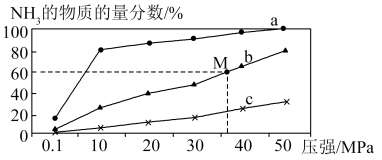
①曲线a对应的温度是________ 。
②M点对应的H2的转化率是________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线a对应的温度是
②M点对应的H2的转化率是
2019高三·全国·专题练习
类题推荐
汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为K= 则此反应的热化学方程式为
则此反应的热化学方程式为___________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g)⇌4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1:p0=___________ 。2~5min内用NO2表示的该反应的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ 。(填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)查阅资料发现,电解法也可制取高纯KIO3,工作原理如图,阳极电极反应方程式为___________ 。隔膜为___________ 交换膜(填“阳离子”或“阴离子”)。

(4)工业生产中可用间接电解法除NO。其原理如图所示:
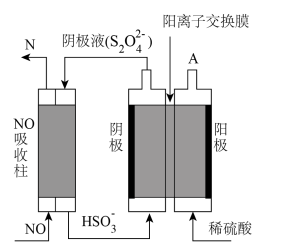
①从A口中出来的物质名称为___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为K=
(2)N2O5在一定条件下可发生分解:2N2O5(g)⇌4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)查阅资料发现,电解法也可制取高纯KIO3,工作原理如图,阳极电极反应方程式为

(4)工业生产中可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质名称为
②写出电解池阴极的电极反应式
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。减轻汽车尾气(CO、NOx)对大气的污染,对这些排放气的处理以及再利用是化学工作者研究的重要课题。请思考回答下列问题:
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g) CH3OH(g) △H1,K1;
CH3OH(g) △H1,K1;
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
CH3OH(g)+H2O(g) △H2=–49kJ·mol-1,K2;
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
CO2(g)+H2(g) △H3=–41.1kJ·mol-1,K3;
(1)则△H1=_______ ,K2=_______ (用K1、K3表示)。
Ⅱ. 是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中为速率常数。
(2)则Kp=_______ (用 表示)。
表示)。
Ⅲ.已知4CO(g)+2NO2(g) 4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
4CO2(g)+N2(g) ∆H=﹣1200kJ•mol﹣1,在恒温恒容下发生上述反应。
(3)能说明该反应达到化学平衡状态的是_______ (填代号)。
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
①0~10min用CO2的浓度变化表示的反应速率为_______ 。
②此温度下,反应的平衡常数Kp=_______ kPa–1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_______ (填“右移”、“左移”或“不移动”)。
Ⅰ.已知H2还原CO合成甲醇的热化学方程式为:
①CO(g)+2H2(g)
②CO2(g)+3H2(g)
③CO(g)+H2O(g)
(1)则△H1=
Ⅱ.
(2)则Kp=
Ⅲ.已知4CO(g)+2NO2(g)
(3)能说明该反应达到化学平衡状态的是
a.v正(CO)=4v逆(N2)
b.CO2和N2的体积比保持不变
c.混合气体的平均相对分子质量保持不变
d.混合气体的密度保持不变
(4)某温度下,向1L恒容密闭容器中充入2molCO和1molNO2,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 120 | 117.44 | 115.36 | 113.12 | 111.52 | 110 | 110 |
②此温度下,反应的平衡常数Kp=
氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)2],请写出此反应的热化学方程式:___________ 。
(2)N2O5 在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量 N2O5,测得 N2O5 浓度随时间的变化如下表:
①反应开始时体系压强为 P0,第 2.00min 时体系压强为 P1,则 P1:P0=_________ 。2.00~5.00min 内用 NO2 表示的该反应的平均反应速率为_________ 。
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是________ (填字母序号)。
a.NO2 和 O2 的浓度比保持不变 b.容器中压强不再变化
c.2v 正(NO2)=v 逆(N2O5) d.气体的平均相对分子质量为 43.2,且保持不变
(3)平衡常数 Kp 是用反应体系中气体物质的分压来表示的,即将K表达式中平衡浓度用平衡分压代替,分压=总压 × 物质的量分数,例如:p(NO2)=p总·x(NO2)(x表示气体的物质的量分数)。
N2O4 与 NO2 转换的热化学方程式为N2O4(g)⇌2NO2(g) △H=+24.4kJ/mol
上述反应中,正反应速率 v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则 Kp 为_________ (以 k 正、k 逆表示)。
(4)下图是密闭反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,合成 NH3 反应达到平衡时,混合物中 NH3 的物质的量分数随压强的变化曲线,已知该反应为放热反应。
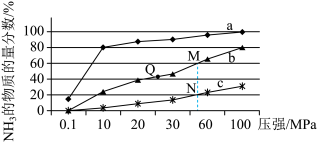
①曲线 a 对应的温度是________ 。
②M 点对应的 H2 的转化率是___________ 。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。通过计算判定(NH4)2SO2 溶液的酸碱性________ 。(写出计算过程,并用简要的文字加以说明)(已知:氨水Kb=1.8×10-5;H2SO3:Ka1=1.3×10-2 Ka2=6.3×10-8)
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)2],请写出此反应的热化学方程式:
(2)N2O5 在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量 N2O5,测得 N2O5 浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为 P0,第 2.00min 时体系压强为 P1,则 P1:P0=
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是
a.NO2 和 O2 的浓度比保持不变 b.容器中压强不再变化
c.2v 正(NO2)=v 逆(N2O5) d.气体的平均相对分子质量为 43.2,且保持不变
(3)平衡常数 Kp 是用反应体系中气体物质的分压来表示的,即将K表达式中平衡浓度用平衡分压代替,分压=总压 × 物质的量分数,例如:p(NO2)=p总·x(NO2)(x表示气体的物质的量分数)。
N2O4 与 NO2 转换的热化学方程式为N2O4(g)⇌2NO2(g) △H=+24.4kJ/mol
上述反应中,正反应速率 v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则 Kp 为
(4)下图是密闭反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,合成 NH3 反应达到平衡时,混合物中 NH3 的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线 a 对应的温度是
②M 点对应的 H2 的转化率是
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。通过计算判定(NH4)2SO2 溶液的酸碱性
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


