填空题 适中0.65 引用1 组卷97
二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。
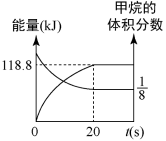
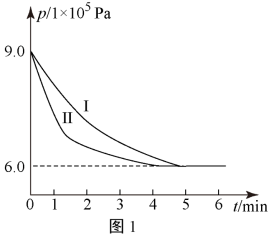
(1)将工业废气中的二氧化碳转化为甲醇,其原理是:CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) △H=-53.7kJ/mol。308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。
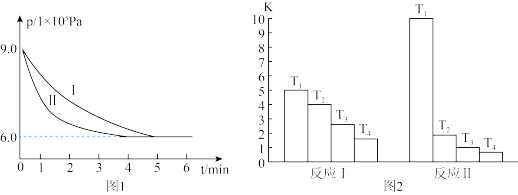
①反应开始至达平衡时,υ(H2)=________ ;该温度下反应的平衡常数为______ 。
②若其他条件相同时,只改变某一条件,曲线变化为II,则改变的条件是_____ 。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)⇌CH3OH(g) △H<0
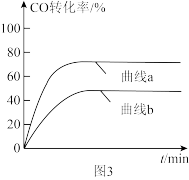
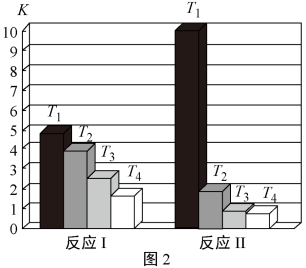
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____ T2(填“>”、“<”或“=”);T2时,CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g)的平衡常数K=_____ 。
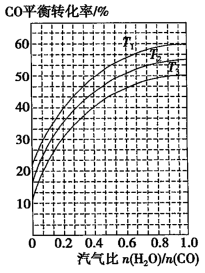
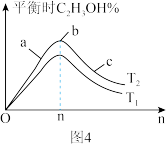
②某科研小组采用反应Ⅱ来合成甲醇,在450℃时,研究了n(H2):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图3),则图中表示n(H2):n(CO)=3:1的变化曲线为______ (填“曲线a"或“曲线b”)。
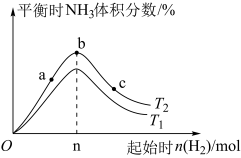
(3)某同学将H2、CO2的混合气体充入一个密闭容器中,控制其他条件不变,改变起始物中H2、CO2的物质的量之比(用n表示)进行反应2CO2(g)+6H2(g) ⇌CH3CH2OH(g)+3H2O(g) △H=Q kJ/mol,实验结果如图4所示(图中T表示温度):
①若图象中T1>T2,则Q______ 0
②比较a、b、c三点所处的平衡状态中,反应物CO2的转化率最高的是____________ ,n=______
(1)将工业废气中的二氧化碳转化为甲醇,其原理是:CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) △H=-53.7kJ/mol。308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。

①反应开始至达平衡时,υ(H2)=
②若其他条件相同时,只改变某一条件,曲线变化为II,则改变的条件是
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)⇌H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)⇌CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1
②某科研小组采用反应Ⅱ来合成甲醇,在450℃时,研究了n(H2):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图3),则图中表示n(H2):n(CO)=3:1的变化曲线为

(3)某同学将H2、CO2的混合气体充入一个密闭容器中,控制其他条件不变,改变起始物中H2、CO2的物质的量之比(用n表示)进行反应2CO2(g)+6H2(g) ⇌CH3CH2OH(g)+3H2O(g) △H=Q kJ/mol,实验结果如图4所示(图中T表示温度):

①若图象中T1>T2,则Q
②比较a、b、c三点所处的平衡状态中,反应物CO2的转化率最高的是
19-20高二上·福建莆田·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 H2O(g)+CH3OH(g)
H2O(g)+CH3OH(g) 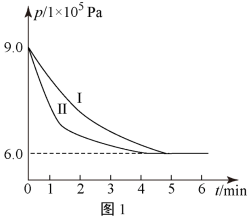

 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);